题目内容
(1)D3+的3d亚层为半充满,其基态原子的价电子排布图为
(2)①CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1mol O22+中含有的π键数目为 .
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型有 ;分子中处于同一直线上的原子数目最多为 .
(3)石墨的片层结构如图所示,试回答:
①平均 个碳原子构成一个正六边形;
②石墨晶体每一层碳原子数与C-C化学键之比为 ;
③12g碳原子可构成 个正六边形.
(2)①CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型有

(3)石墨的片层结构如图所示,试回答:
①平均
②石墨晶体每一层碳原子数与C-C化学键之比为
③12g碳原子可构成
分析:(1)D3+的3d亚层为半充满的元素是Fe元素,Fe原子价层电子为3d64s2;
(2)①等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
②丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;
(3)利用均摊法进行有关计算.
(2)①等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
②丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;
(3)利用均摊法进行有关计算.
解答:解:(1)D3+的3d亚层为半充满的元素是Fe元素,Fe原子价层电子为3d64s2,其价电子排布图为: ,
,
故答案为: ;
;
(2)①根据等电子体原理可知,O22+的电子式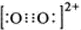 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
故答案为: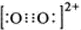 ;2NA;
;2NA;
②通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;故答案为:sp杂化、sp2杂化;3;
(3)①一个正六边形含有碳原子个数=6×
=2,
故答案为:2;
②一个碳原子含有的碳碳键个数=
×3=1.5,所以碳原子个数和碳碳键个数比=1:1.5=2:3,
故答案为:2:3;
③一个正六边形含有碳原子个数=6×
=2,12g碳原子的个数是NA个,所以能形成正六边形个数=
=0.5NA,
故答案为:0.5NA.
 ,
,故答案为:
 ;
;(2)①根据等电子体原理可知,O22+的电子式
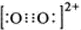 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:
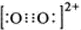 ;2NA;
;2NA;②通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;故答案为:sp杂化、sp2杂化;3;
(3)①一个正六边形含有碳原子个数=6×
| 1 |
| 3 |
故答案为:2;
②一个碳原子含有的碳碳键个数=
| 1 |
| 2 |
故答案为:2:3;
③一个正六边形含有碳原子个数=6×
| 1 |
| 3 |
| NA |
| 2 |
故答案为:0.5NA.
点评:本题考查了电子排布图的书写、原子杂化方式的判断、石墨的有关计算,根据价层电子对互斥理论确定原子杂化方式,(3)根据均摊法进行有关计算,难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目

