题目内容
铝可与硝酸钠发生反应(未配平):Al+NaNO3+H2O→Al(OH)3+N2↑+NaAlO2,有关叙述正确的是( )
| A、上述反应中水是氧化剂 |
| B、若反应过程中转移5 mol e-则生成标准状况下N2的体积为11.2L |
| C、该反应的氧化产物是N2 |
| D、当消耗1 mol Al时,生成标况下N2的体积为22.4L |
考点:氧化还原反应
专题:
分析:Al+NaNO3+H2O→Al(OH)3↓+N2↑+NaAlO2中,Al元素的化合价升高作还原剂,NaNO3中的N元素的化合价降低作氧化剂,以此来解答.
解答:
解:A.水中H、O元素的化合价不变,则不作氧化剂,故A错误;
B.由N元素的化合价变化+5→0可知,生成1molN2转移10mol电子,则转移5mol电子,则生成标准状况下N2的体积为0.5mol×22.4L/mol=11.2L,故B正确;
C.因N元素的化合价降低,则还原产物为N2,故C错误;
D.由电子守恒可知,10molAl反应生成3molN2,则消耗1molAl时,生成标准状况下N2的体积为0.3mol×22.4L/mol=6.72L,故D错误;
故选B.
B.由N元素的化合价变化+5→0可知,生成1molN2转移10mol电子,则转移5mol电子,则生成标准状况下N2的体积为0.5mol×22.4L/mol=11.2L,故B正确;
C.因N元素的化合价降低,则还原产物为N2,故C错误;
D.由电子守恒可知,10molAl反应生成3molN2,则消耗1molAl时,生成标准状况下N2的体积为0.3mol×22.4L/mol=6.72L,故D错误;
故选B.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
生活是化学的源泉,下列有关叙述错误的是( )
| A、将碘酒滴在鲜土豆片表面,变蓝证明土豆含淀粉 |
| B、利用有机合成能制造出硬度较大的新材料 |
| C、明矾加入污水中可形成胶体,沉降悬浮物 |
| D、发酵粉中主要含有纯碱,使焙制糕点疏松多孔 |
下列说法不正确的是( )
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阴离子必有阳离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阴离子必有阳离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
| A、①②④⑤⑥⑦ |
| B、②③⑤⑦ |
| C、③⑤⑥⑦ |
| D、①②③④⑤⑥ |
下列关于工业生产的说法中正确的是( )
| A、氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应 |
| B、硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 |
| C、电解精炼铜时,纯铜作为阳极,粗铜作为阴极 |
| D、工业合成氨通常采用500℃的高温主要是为了提高氮气的转化率 |
反应C ( s)+H2O (g)═CO ( g)+H2 (g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A、增加C的量 |
| B、将容器的体积缩小一半 |
| C、升高反应的温度 |
| D、保持压强不变充入N2 使容器体积变大 |
1mol/L NaOH溶液的含义是( )
| A、1L水中含有1molNaOH |
| B、1L溶液中含有40gNaOH |
| C、溶液中含有40gNaOH |
| D、将40gNaOH溶于1L水中所得的溶液 |
下列叙述中,不正确的是( )
| A、CaCO3属于碳酸盐 |
| B、盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| C、蓝矾(CuSO4?5H2O)和干冰属于化合物,铁矿石属于混合物 |
| D、通过化学反应,可由Ba(OH)2一步转化生成NaOH |
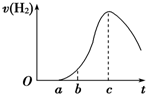 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题: (1)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能.设计两种类型的原电池,探究其能量转化效率.
(1)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能.设计两种类型的原电池,探究其能量转化效率.