题目内容
已知KSP(AgCl)=1.8×l0-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是多少?(已知
=1.3)
| 1.8 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:KSP(AgCl)=c(Cl-)×c(Ag+),将AgCl放在蒸馏水中形成饱和溶液,应满足c(Cl-)×c(Ag+)≥KSP(AgCl),以此计算.
解答:
解:将AgCl放在蒸馏水中形成饱和溶液,应满足c(Cl-)×c(Ag+)≥KSP(AgCl),因KSP(AgCl)=c(Cl-)×c(Ag+),
则c(Cl-)=c(Ag+)≥
mol/L=1.3×10-5mol/L,
答:溶液中的C(Ag+)是1.3×10-5mol/L.
则c(Cl-)=c(Ag+)≥
| 1.8×10-10 |
答:溶液中的C(Ag+)是1.3×10-5mol/L.
点评:本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握计算公式的运用,难度不大.

练习册系列答案
相关题目
某物质可能有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种,在鉴定时有下列现象:下列叙述正确的是( )
①有银镜反应,
②加入新制Cu(OH)2悬浊液沉淀不溶解,
③与含酚酞的NaOH溶液共热,发现溶液中红色逐渐褪去以至无色.
①有银镜反应,
②加入新制Cu(OH)2悬浊液沉淀不溶解,
③与含酚酞的NaOH溶液共热,发现溶液中红色逐渐褪去以至无色.
| A、几种物质都有 |
| B、有甲酸乙酯和甲酸 |
| C、有甲酸乙酯和甲醇 |
| D、有甲酸乙酯,可能有甲醇 |
某学生将一氯丙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果未见到白色沉淀生成,其主要原因是( )
| A、加热时间太短 |
| B、不应冷却后再滴入AgNO3溶液 |
| C、加AgNO3溶液后未加稀HNO3 |
| D、加AgNO3溶液前未用稀HNO3 |





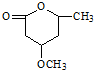 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从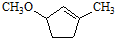 到
到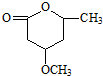 的合成路线(用合成路线流程图表示,并注明反应条件).
的合成路线(用合成路线流程图表示,并注明反应条件). …
…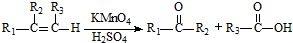 ;
;