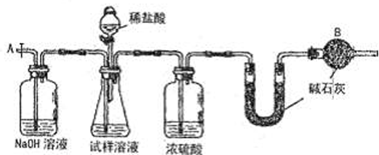
题目内容
一定量Na2CO3和NaHCO3混合物与足量盐酸反应共消耗HCl a mol,放出CO2 b mol, 则Na2CO3和NaHCO3的物质的量之比为____________________.
![]()
答案:3
解析:
提示:
解析:
|
设Na2CO3的物质的量为x, NaHCO3的物质的量为y Na2CO3+2HCl =2NaCl+H2O+CO2↑ 1 2 1 X 2X X NaHCO3+HCl=NaCl+H2O+CO2↑ y y y 2x + y = a ① x + y= b ② x= b - y 代入①2b-2y+y=a
y=2b-a x=b-2b+a=a-b |
提示:
|
Na2CO3+2HCl=2NaCl+CO2↑+H2O X 2X X NaHCO3+HCl =NaCl+ CO2↑+ H2O y y y |

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
将一定量CO2通入NaOH溶液中,将充分反应后的溶液减压蒸发得到固体.下列对所得固体的成分说法中不正确的是( )
| A、所得固体可能由NaOH和Na2CO3组成 | B、所得固体可能由NaOH和NaHCO3组成 | C、所得固体可能由Na2CO3和NaHCO3组成 | D、所得固体可能只含有NaHCO3 |