��Ŀ����
����Ŀ����ҵ�Ͽ������÷����е�CO2Ϊԭ����ȡ�״����䷴Ӧ����ʽΪ��CO2+3H2![]() CH3OH+H2O����ش��������⣺
CH3OH+H2O����ش��������⣺
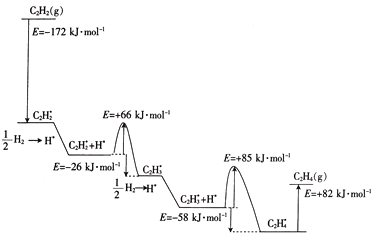
��1����֪���³�ѹ�����з�Ӧ�������仯��ͼ1��ʾ��
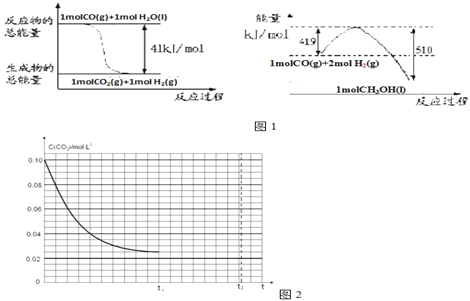
д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ______________________________���÷�Ӧ�ġ�S_______0�������������=��������________����������ڸ÷�Ӧ�Է����У�����¡����¡�����
��2�����������Ӧ����ʽ��ƽ�ⳣ��Kֵ�����÷�Ӧ_________��ѡ���ţ���
A��һ��������Ӧ�����ƶ� B����ƽ���ƶ�ʱ����Ӧ������������С
C��һ�����淴Ӧ�����ƶ� D����ƽ���ƶ�ʱ�淴Ӧ�����ȼ�С������
��3������Ӧ�������ݻ�Ϊ2.0L��CO2��H2����ʼŨ�ȷֱ�Ϊ0.10 mol��L-1��0.30 mol��L-1��
������Ӧʱ��Ϊ4.0min��������������ܶȼ�����2.0g/L���������ʱ����CO2��ƽ����Ӧ����Ϊ__________��
������Ӧ��t1ʱ�ﵽƽ�⣬������c��CO2����ʱ��t�仯����������ͼ2��ʾ�����������������䣬t1ʱ���������ѹ����1L���뻭��t1��c��CO2����ʱ��t�仯�������ߣ�t2�ﵽ�µ�ƽ�⣩______________��
���𰸡�3H2(g) + CO2(g)��CH3OH(l)+ H2O(l) ��H=��50kJ/mol �� ���� AD 0.01mol/(L��min) 
��������
��1����������ɵ��Ȼ�ѧ����ʽ����CO(g)+H2O(l)=CO2(g)+H2(g) ��H=��41kJ/mol����CO(g) +H2(g)=CH3OH(l)��H=��91kJ/mol�����ݸ�˹���ɣ��ɢڣ��٣������ɵ�3H2(g) + CO2(g)=CH3OH(l)+ H2O(l)��H=��50kJ/mol���ɷ���ʽ��֪���÷�Ӧ��һ����ϵ�Ļ��ҳ̶ȼ�С�ķ�Ӧ�����ԡ�S��0�����ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ�ڵ�������������ڸ÷�Ӧ�Է����У�
��2�����ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������������Ӧ����ʽ��ƽ�ⳣ��Kֵ�����ƽ�������ƶ�������Kֻ���¶��йأ�����ѹǿ��Ũ�ȵ��أ�����ֻ���¶Ƚ��Ͳſ�������������������ʱ��V����V������С��V����С�Ķ࣬V����V����ƽ�������ƶ����淴Ӧ�����ȼ�С�����������ӡ���ѡAD��
��3���ٷ�Ӧ�������ݻ�Ϊ2.0L��������������ܶȼ�����2.0g/L�������������������2.0g/L��2.0L=4.0g�����м��ٵ�CO2������Ϊ4��![]() =3.52g��������n(CO2)=
=3.52g��������n(CO2)=![]() =
=![]() =0.08mol�����V(CO2)=
=0.08mol�����V(CO2)= ![]() =
=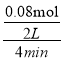 = 0.01mol/(L��min)��
= 0.01mol/(L��min)��
�ڵ����������������䣬t1ʱ���������ѹ����1L��˲�������̼Ũ�ȡ���������Ϊc(CO2)=0.05mol/L��c(H2)=0.15mol/L��ƽ�������ƶ���������c(CO2)=xmol/L��������c(H2)=3xmol/L��ƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(CO2)=(0.05-x)mol/L��c(H2)=(0.15-3x)mol/L��ƽ�ⳣ�����䡣��![]() =
=![]() �����x=0.025mol/L����t2�ﵽ�µ�ƽ��ʱc(CO2)=0.025mol/L����t1��c(CO2)��ʱ��t�仯��������Ϊ��ͼ��ʾ
�����x=0.025mol/L����t2�ﵽ�µ�ƽ��ʱc(CO2)=0.025mol/L����t1��c(CO2)��ʱ��t�仯��������Ϊ��ͼ��ʾ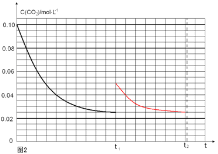 ��
��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�����¶�Ϊ![]() ��Ũ��Ϊ
��Ũ��Ϊ![]() ��
��![]() �ļ���Һ��50mL���
�ļ���Һ��50mL���![]() ����Һ���ܶȾ�Ϊ
����Һ���ܶȾ�Ϊ![]() ��������Ϊ
��������Ϊ![]() �������������������Һ���¶ȱ仯�������£�
�������������������Һ���¶ȱ仯�������£�
��Ӧ�� | ��ʼ�¶� | ��ֹ�¶� |
| 20 |
|
| 20 |
|
��Ӧ![]() ���ʱ�ԼΪ(��λ��
���ʱ�ԼΪ(��λ��![]() )
)
A.![]() B.
B.![]()
C.![]() D.ȱ�����ݣ�������
D.ȱ�����ݣ�������