题目内容
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,回答下列问题.
(1)图1仪器A的名称 ;碎泡沫塑料的作用是 .
(2)环形玻璃搅拌棒不能用环形铜质搅拌棒代替,其原因是: .
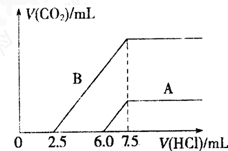
(3)将V1mL1.0mol?L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 ;
假设盐酸与氢氧化钠起始温度平均值为21.0℃,图2中最高温度为28.0℃,并近似认为NaOH溶液和盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).则中和热△H= (取小数点后一位). (提示:Q=cm△t)
(1)图1仪器A的名称
(2)环形玻璃搅拌棒不能用环形铜质搅拌棒代替,其原因是:
(3)将V1mL1.0mol?L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为
假设盐酸与氢氧化钠起始温度平均值为21.0℃,图2中最高温度为28.0℃,并近似认为NaOH溶液和盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).则中和热△H=

考点:中和热的测定
专题:化学反应中的能量变化
分析:(1)环形玻璃搅拌棒上下移动搅拌的面积大、范围广、混合均匀;为防止热量散失在两个烧杯间填装碎泡沫塑料;
(2)中和实验要防止热量的散失,铜是热的良导体;
(3)根据酸碱中和反应计算氢氧化钠浓度;根据Q=cm△t计算中和热.
(2)中和实验要防止热量的散失,铜是热的良导体;
(3)根据酸碱中和反应计算氢氧化钠浓度;根据Q=cm△t计算中和热.
解答:
解:(1)环形玻璃搅拌棒上下移动搅拌的面积大、范围广、混合均匀,实验效果更好;为防止热量散失在两个烧杯间填装碎泡沫塑料;
故答案为:环形玻璃搅拌棒;保温隔离隔热作用;
(2)本实验要防止反应体系和外界的热量交换,铜是热的良好导体,容易造成热量的损失,而玻璃是热的不良导体,热量散失较少,故环形玻璃搅拌棒不能用环形铜质搅拌棒代替;
故答案为:铜棒易导致热量的散失;
(3)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL.酸碱中和可列式:30mL×1mol?L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol?L-1;
由Q=cm△t得,该反应放出热量 Q=50g×4.18 J/(g?℃)×(28℃-21℃)=1463J,且该反应Q所放出的热量为形成30ml×1mol/L=0.03mol水时所放出的热量,
故中和热△H=-1.463kJ÷0.03mol=-48.8 kJ?mol-1.
故答案为:1.5 mol?L-1;-48.8 kJ?mol-1.
故答案为:环形玻璃搅拌棒;保温隔离隔热作用;
(2)本实验要防止反应体系和外界的热量交换,铜是热的良好导体,容易造成热量的损失,而玻璃是热的不良导体,热量散失较少,故环形玻璃搅拌棒不能用环形铜质搅拌棒代替;
故答案为:铜棒易导致热量的散失;
(3)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL.酸碱中和可列式:30mL×1mol?L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol?L-1;
由Q=cm△t得,该反应放出热量 Q=50g×4.18 J/(g?℃)×(28℃-21℃)=1463J,且该反应Q所放出的热量为形成30ml×1mol/L=0.03mol水时所放出的热量,
故中和热△H=-1.463kJ÷0.03mol=-48.8 kJ?mol-1.
故答案为:1.5 mol?L-1;-48.8 kJ?mol-1.
点评:本题考查酸碱混合的定性判断和计算,结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,综合性较强,要认真分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
室温下,对于0.10mol?L-1的氨水,下列判断正确的是( )
| A、与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | ||
B、加水稀释后,溶液中c(NH
| ||
| C、用HNO3溶液完全中和后,溶液不显中性 | ||
| D、其溶液的pH小于13 |


 含氯消毒剂和过氧化物等强氧化性消毒剂可用于环境杀菌消毒.
含氯消毒剂和过氧化物等强氧化性消毒剂可用于环境杀菌消毒.
