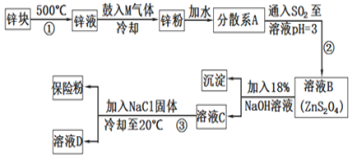
题目内容
【题目】在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:Cr2O72-(aq) + H2O(l)![]() 2CrO42- (aq) +2H+(aq)
2CrO42- (aq) +2H+(aq)
(1)写出上述反应的平衡常数表达式:K=_______________________。
(2)向重铬酸钾中加入少量NaOH固体,溶液呈_________色。
(3)向(2)所得的溶液中加入过量的稀硫酸,则溶液呈________色,因为_______________。
(4)向原溶液中加入Ba(NO3)2溶液(BaCrO4为难溶性黄色沉淀),则平衡_________(填“正向移动”、“逆向移动”或“不移动”),溶液颜色将_______________。
【答案】K=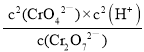 黄 橙红色 加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色 正向移动 变浅
黄 橙红色 加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色 正向移动 变浅
【解析】
在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:Cr2O72-(aq) + H2O(l)![]() 2CrO42- (aq) +2H+(aq)
2CrO42- (aq) +2H+(aq)
(1)根据Cr2O72-(aq) + H2O(l)![]() 2CrO42- (aq) +2H+(aq),反应的平衡常数表达式:K=
2CrO42- (aq) +2H+(aq),反应的平衡常数表达式:K=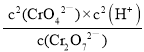 。
。
(2)向重铬酸钾中加入少量NaOH固体,与H+反应,平衡正向移动,溶液呈黄色。
(3)向(2)所得的溶液中加入过量的稀硫酸,H+浓度增大,平衡逆向移动,则溶液呈橙红色,故理由为:加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色。
(4)向原溶液中加入Ba(NO3)2溶液(BaCrO4为难溶性黄色沉淀),CrO42-浓度减小,则平衡正向移动,Cr2O72-浓度减小,溶液颜色将变浅。

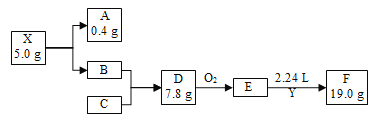
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V,根据相关数据所绘制的图象如图所示,则曲线a、b、c、d所对应的实验组别可能依次是( )
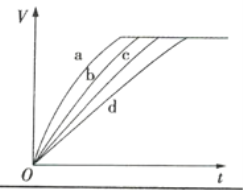
实验组别 | c(HCl)/(mol·L-1) | 温度/℃ | 形状(Fe) |
1 | 2.0 | 30 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.4、3、2、1B.1、2、3、4
C.3、4、2、1D.1、2、4、3
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度