题目内容
 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是( )
| A、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| B、原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
| C、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D、d点溶液中含有的溶质只有NaAlO2 |
考点:离子方程式的有关计算
专题:
分析:根据图象第一段,沉淀不是马上出现,可知一定有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面溶解一部分,一定有铝离子,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含碳酸氢根离子和镁离子,即原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,据此回答判断.
解答:
解:根据图象第一段,沉淀不是马上出现,可知一定有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面溶解一部分,一定有铝离子,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含碳酸氢根离子和镁离子,即原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,
A、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,故A错误;
B、原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,故B错误;
C、根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,含有的Fe3+和Al3+的物质的量之比为1:1,故C正确;
D、d点溶液中含有的溶质有NaAlO2,还有NH3?H2O,故D错误.
故选C.
A、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,故A错误;
B、原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,故B错误;
C、根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,含有的Fe3+和Al3+的物质的量之比为1:1,故C正确;
D、d点溶液中含有的溶质有NaAlO2,还有NH3?H2O,故D错误.
故选C.
点评:本题是一道有关离子检验的综合知识题目,考查角度很广,难度较大.

练习册系列答案
相关题目
下列关于元素及其化合物的说法正确的是( )
| A、Fe在常温下可与浓硝酸、稀硝酸、浓硫酸发生现象剧烈的反应 |
| B、Al、Al2O3、Al(OH)3、NaAlO2均能和NaOH溶液发生反应 |
| C、NaHCO3可用于制备纯碱、治疗胃酸过多的药剂、食品发酵剂 |
| D、制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法 |
贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用.但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se.在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl═Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O.下列叙述正确的是( )
| A、反应①中Se是氧化产物,I2是还原产物 |
| B、反应②中浓H2SO4是氧化剂,SeO2是还原产物 |
| C、反应①中每有1.0mol I2生成,转移电子数目为4 NA |
| D、SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 |
下列化学用语的书写正确的是( )
| A、NaH2PO4的水解:H2PO4-+H2O?H3O++HPO42- |
| B、H2S在水中的电离:H2S?2H++S2- |
| C、Na2SO3的水解:SO32-+H2O?HSO3-+OH- |
| D、CH3COONa在水中的电离:CH3COONa?CH3COO-+Na+ |
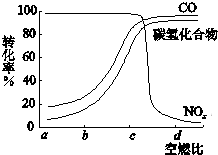 为使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果.
为使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果.