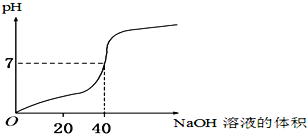
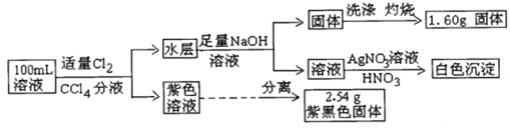
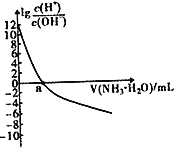
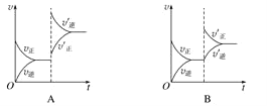
题目内容
【题目】用如图所示的装置分别进行如下实验,各离子方程式正确及各组物质反应后,溶液的导电性比反应前增强的是( )
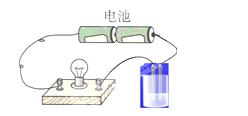
A.向硝酸银溶液中通入少量氯化氢:Ag++Cl-=AgCl↓
B.向亚硫酸溶液中通入氯气:H2SO3+C12+H2O=SO42-+4H++2Cl-
C.向FeBr2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
D.向NaOH溶液中通入少量氯气:2OH-+Cl2=Cl-+ClO-+H2O
【答案】BC
【解析】
溶液的导电性与离子浓度成正比,溶液的导电性比反应前明显增强,说明反应后溶液中离子浓度增大;
A.该反应生成沉淀,同时还生成硝酸,溶液中离子浓度变化不大,所以溶液导电性变化不大,故A错误;
B.亚硫酸是弱电解质,溶液中离子浓度较小,通入氯气后生成硫酸和HCl,二者都是强电解质,导致溶液中离子浓度增大,则溶液导电性增强,故B正确;
C.向FeBr2溶液中通入少量氯气发生的离子反应式为2Fe2++Cl2=2Fe3++2Cl-,溶液中Cl-浓度增加,则溶液导电性增强,故C正确;
D.氢氧化钠是强电解质,氯气和氢氧化钠反应生成强电解质氯化钠、次氯酸钠和水,离子浓度变化不明显,溶液导电能力变化不明显,故D错误;
故答案为BC。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);