题目内容
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):该反应达平衡后,改变条件,下列说法正确的是( )
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)?2PbCrO4(s)+2H+(aq)△H<0.
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)?2PbCrO4(s)+2H+(aq)△H<0.
| A、移走部分PbCrO4固体,Cr2O72-转化率升高 |
| B、升高温度,该反应的平衡常数(K)增大 |
| C、加入少量NaOH固体,自然沉降后,溶液颜色变浅 |
| D、加入少量K2Cr2O7固体后,溶液中c(H+)不变 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、固体对平衡无影响;
B、反应是放热反应,升温平衡逆向进行;
C、氢氧化钠和氢离子反应,平衡正向进行溶液颜色变浅;
D、加入少量K2Cr2O7固体后,平衡正向进行,氢离子浓度增大;
B、反应是放热反应,升温平衡逆向进行;
C、氢氧化钠和氢离子反应,平衡正向进行溶液颜色变浅;
D、加入少量K2Cr2O7固体后,平衡正向进行,氢离子浓度增大;
解答:
解:A、固体对平衡无影响,移走部分PbCrO4固体,Cr2O72-转化率不变,故A错误;
B、反应是放热反应,升温平衡逆向进行,平衡常数减小,故B错误;
C、氢氧化钠和氢离子反应,平衡正向进行,生成固体2PbCrO4(s),溶液颜色变浅,故C正确;
D、加入少量K2Cr2O7固体后,平衡正向进行,氢离子浓度增大,故D错误;
故选C.
B、反应是放热反应,升温平衡逆向进行,平衡常数减小,故B错误;
C、氢氧化钠和氢离子反应,平衡正向进行,生成固体2PbCrO4(s),溶液颜色变浅,故C正确;
D、加入少量K2Cr2O7固体后,平衡正向进行,氢离子浓度增大,故D错误;
故选C.
点评:本题考查了化学平衡影响因素分析判断,平衡移动原理的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列物质的分子中,既有σ键又有π键的是( )
| A、C2H6 |
| B、HClO |
| C、CH4 |
| D、CO2 |
下列各组中两个变化所发生的反应,属于同一类型的是( )
| A、由苯制环己烷、由乙烷制溴乙烷 |
| B、乙烯使溴水褪色、乙烯使酸性高锰酸钾水溶液褪色 |
| C、由乙烯制聚乙烯、石蜡油分解制烯烃 |
| D、由苯制硝基苯、由苯制溴苯 |
下列说法正确的是( )
①相同质量的CH4、C2H4、C2H2完全燃烧时耗O2量的关系为CH4>C2H4>C2H2
②对于任意比混合的乙烯、丙烯和环丁烷混合气体在足量氧气中燃烧,
只要混合气体的质量不变,完全燃烧后产生的CO2和H2O的量也不改变
③对于任意比混合的C2H4、C2H6、C2H2混合气体,只要混合气体物质的量不变,完全燃烧后产生的CO2物质的量也不改变
④某有机物在足量氧气中燃烧后产生CO2与H2O的物质的量之比为2:3,
则该有机物的类型肯定为烷烃.
①相同质量的CH4、C2H4、C2H2完全燃烧时耗O2量的关系为CH4>C2H4>C2H2
②对于任意比混合的乙烯、丙烯和环丁烷混合气体在足量氧气中燃烧,
只要混合气体的质量不变,完全燃烧后产生的CO2和H2O的量也不改变
③对于任意比混合的C2H4、C2H6、C2H2混合气体,只要混合气体物质的量不变,完全燃烧后产生的CO2物质的量也不改变
④某有机物在足量氧气中燃烧后产生CO2与H2O的物质的量之比为2:3,
则该有机物的类型肯定为烷烃.
| A、①②③ | B、①②③④ |
| C、②③ | D、以上组合均不正确 |
下列物质中,摩尔质量最大的是( )
| A、1gCaCO3 |
| B、0.8molH2SO4 |
| C、10mlH2O |
| D、54gAl |
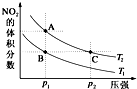 反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法不正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法不正确的是( )| A、B、C两点N2O4的转化率:B=C |
| B、A、C两点气体的颜色:A浅,C深 |
| C、A、C两点N2O4的转化率:A>C |
| D、状态B和状态A,平衡常数:A<B |
下列反应的离子方程式书写不正确的是( )
| A、氯化铝溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| B、铜跟浓硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
| C、铁跟氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
| D、氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |