题目内容
18.某同学用铅蓄电池作电源,用石墨作电极电解500mL某浓度的AgNO3溶液,观察到A电极表面有金属生成,B电极上有无色气体产生.当溶液中原有溶质完全电解后,停止通电,取出A极,洗涤、干燥、称量,电极增重5.4g.已知铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O.请按要求回答下列问题:
(1)A电极为电解池的阴极,B电极上产生的气体为氧气(或O2).
(2)当反应过程中转移的电子为0.01mol时,铅蓄电池内消耗硫酸的物质的量为0.01mol.
(3)铅蓄电池放电时,电解液的pH增大(填“增大”、“减小”或“不变”).
分析 (1)电解池中,有金属析出的电极是阴极,所以A是阴极,B是阳极,根据离子的放电顺序确定电极产物;
(2)根据铅蓄电池反应的化学方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O结合电子转移情况进行计算;
(3)铅蓄电池放电时的化学方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O,据此回答.
解答 解:(1)电解池中,有金属析出的电极是阴极,所以A是阴极,B是阳极,电解硝酸银,在阳极上是氢氧根离子失电子的氧化反应,产物是氧气,
故答案为:阴;氧气(或O2);
(2)铅蓄电池反应的化学方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O,当反应过程中转移的电子为2mol时,铅蓄电池内消耗硫酸的物质的量为2mol,所以当反应过程中转移的电子为0.01mol时,铅蓄电池内消耗硫酸的物质的量为0.01mol,故答案为:0.01;
(3)铅蓄电池放电时的化学方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O,消耗硫酸,所以电解液的pH增大,故答案为:增大.
点评 本题考查了电解原理的分析应用,主要是电极反应和电极判断,电子守恒是电化学计算的依据,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | a molH2O和a molCO2所含分子数目相同 | |
| C. | 1mol氦气含有的氦原子物质的量是2mol | |
| D. | 摩尔是国际单位制中七个物理量之一 |
7.下列叙述不正确的是( )
| A. | 用熟石灰可处理酸性废水 | B. | 焊锡(锡铅合金)熔点比金属锡高 | ||
| C. | 用丁达尔效应可区分溶液和胶体 | D. | 用热的纯碱溶液可清除油污 |





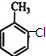
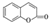 )是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下:
)是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下: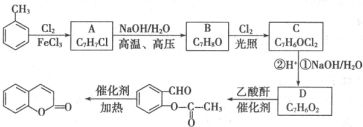
 ,D的结构简式是
,D的结构简式是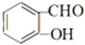 .
.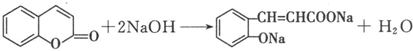 .
. .
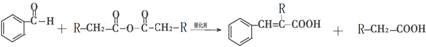
.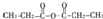 ,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是
,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是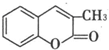 .
.