题目内容
10.铍的性质类似于铝,下列有关铍性质和结构的推断正确的是( )| A. | 铍与铝原子核外具有相同的未成对电子数 | |
| B. | 氢氧化铍能与强酸、强碱溶液反应 | |
| C. | 铍与铝元素具有相同的最高正化合价 | |
| D. | 氧化铍只溶于强酸溶液,不溶于强碱溶液 |
分析 A、铍与铝的核外电子排布分别为:2s2和3s23p1,铍全部成对而铝有一个未成对;
B、在周期表中铍和铝的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,Be(OH)2与氢氧化铝的性质相似,氢氧化铝是两性氢氧化物,则Be(OH)2也具有两性;
C、最高正化合价等于最外层电子数;
D、在周期表中铍和铝的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,Al2O3和BeO的性质相似.
解答 解:A、铍与铝的核外电子排布分别为:2s2和3s23p1,铍全部成对而铝有一个未成对,所以两者未成对电子数不等,故A错误;
B、在周期表中铍和铝的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,Be(OH)2与氢氧化铝的性质相似,氢氧化铝是两性氢氧化物,则Be(OH)2也具有两性,所以氢氧化铍能与强酸、强碱溶液反应生成盐和水,故B正确;
C、最高正化合价等于最外层电子数,最高正化合价分别为+2和+3价,故C错误;
D、在周期表中铍和铝的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,Al2O3和BeO的性质相似,所以氧化铍既能溶于强酸溶液,又能溶于强碱溶液,故D错误;
故选B.
点评 本题考查了元素周期表与元素周期律的应用,题目难度不大,注意掌握元素周期表结构、元素周期律内容,明确元素周期表与元素周期律的应用方法.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
18.下列关于胶体的认识正确的是( )
| A. | 鸡蛋清在水中形成的分散系是一种液溶胶,往其中加入饱和(NH4)2SO4溶液会生成白色沉淀 | |
| B. | 可用丁达尔效应来区分胶体和溶液 | |
| C. | 胶体中存在布朗运动,其他分散系中不存在布朗运动 | |
| D. | 某纯净纳米材料其粒子直径从几纳米到几十纳米,该纳米材料属于胶体 |
1.食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A. | 含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) | |
| B. | 脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ | |
| C. | 脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- | |
| D. | 加入脱氧剂的目的是因为该反应是吸热过程,可降低温度,延长食品保质期 |
18.下列各组有机物,不管它们以何种比例混合,只要总质量一定,则完全燃烧时消耗氧气为一定值的是( )
| A. | C4H6、C3H8 | B. | C2H2、C6H6 | C. | C2H6O、C2H4 | D. | C3H6、C3H8 |
5.元素周期表短周期的一部分.其中F原子的电子层数为n,最外层电子数为2n+1,核内质子数为2n2-1.下列说法不正确的是( )
| A | B | C | |
| D | E | F |
| A. | D的单质是常见的半导体材料 | |
| B. | B与E形成的化合物不只一种 | |
| C. | C与F的原子序数之差为8 | |
| D. | A的最高价氧化物的水化物能和Al(OH)3反应 |
15.关于晶体的下列叙述正确的是( )
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 离子晶体中可能含有共价键 | |
| C. | 原子晶体中的相邻原子间只存在非极性共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |
2.某化合物在核磁共振氢谱中出现6个峰,其结构简式可能是( )
| A. |  | B. | 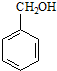 | C. |  | D. | 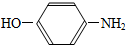 |
19.某有机物结构如图,有关该有机物说法不正确的是( )


| A. | 该有机物难溶于水 | |
| B. | 该物质能与溴水反应,生成难溶于水的沉淀 | |
| C. | 该分子中至少有12个原子共平面 | |
| D. | 1 mol该物质与足量的金属钠反应,放出3mol H2 |
20.在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)?3C(g)+2D(g),达到平衡状态的是( )
| A. | 混合气的平均相对分子质量不再改变 | |
| B. | 反应器内A、B、C、D物质的量比为1:3:3:2 | |
| C. | 容器内密度不随时间变化而变化 | |
| D. | 生成 1mol A同时有3 mol C被消耗 |