题目内容
8. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | Ⅱ为盐酸稀释时的pH值变化曲线 | |
| B. | b点酸的总浓度大于a点酸的总浓度 | |
| C. | a点Kw的数值比c点Kw的数值大 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
分析 根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线,利用c点、b点溶液中的离子浓度来分析导电性;Kw只与温度有关,与溶液的种类以及浓度大小没有关系;相同pH值的盐酸和醋酸,稀释到相同体积时,醋酸(II)浓度大于盐酸(I)浓度.
解答 解:A、Ⅱ应为醋酸稀释时的pH值变化曲线,故A错误;
B、相同pH值的盐酸和醋酸,醋酸浓度远大于盐酸的浓度,稀释到相同体积时,醋酸(Ⅱ)浓度大于盐酸(Ⅰ)浓度,即b点酸的总浓度小于a点酸的总浓度,故B错误;
C、Kw的大小只取决于温度,所以a点Kw的数值等于c点Kw的数值,故C错误;
D、溶液导电性取决于离子浓度,b点的H+浓度大,导电性强,故D正确.
故选D.
点评 本题考查强弱电解质溶液稀释时的浓度变化,注意加水促进弱电解质电离的特点.

练习册系列答案
相关题目
19.一定条件下,在2L密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,测得1min内,H2的物质的量由3mol减少到1.2mol,则1min内NH3的化学反应速率为( )
| A. | 0.6 mol•L-1•min-1 | B. | 0.9 mol•L-1•min-1 | ||
| C. | 1.2 mol•L-1•min-1 | D. | 1.8 mol•L-1•min-1 |
3.0.8g某气体含有3.01×1022个分子,该气体的摩尔质量为( )
| A. | 16 g•mol-1 | B. | 16 0g•mol-1 | C. | 64 g•mol-1 | D. | 8 g•mol-1 |
20.下列各组物质按酸、碱、盐分类顺次排列的是( )
| A. | 硫酸、纯碱、胆矾 | B. | 硝酸、烧碱、食盐 | ||
| C. | 醋酸、乙醇、硫酸铵 | D. | 盐酸、熟石灰、苛性钠 |
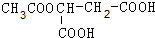 +H2O.
+H2O.
 已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族,
已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族, .
.