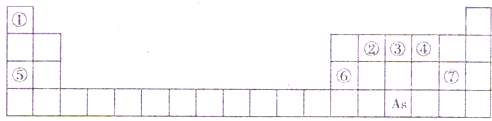
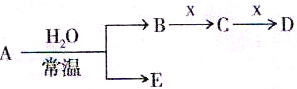
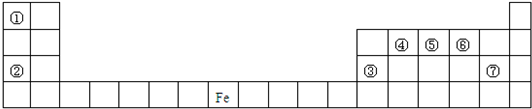
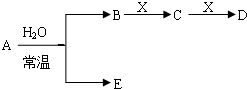
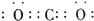题目内容
| |||||||||||
解析:
(1) |
设每份混合物中含Na2O2、NaHCO3的物质的量分别为x、y 因为2Na2O2+4HCl=4NaCl+O2↑+2H2O,NaHCO3+HCl=NaCl+CO2↑+H2O 2 mol 4 mol 1mol 1 mol 1 mol 1 mol x 2x 故 第一份产生的气体与第二份固体反应时,当Na2O2足量,则有: 2Na2O2+2CO2=2Na2CO3+O2↑ Δn减 2 mol 1 mol 1 mol y ( 解得y=0.02 mol,代入①式得x=0.16 mol 故原混合物中Na2O2有0.32 mol,NaHCO3有0.04 mol 盐酸的物质的量浓度为 |
(2) |
当Na2O2不足量时,则有 2Na2O2+2CO2=2Na2CO3+O2↑ Δn减 2 mol 1 mol x 0.01 mol 解得x=0.02 mol,代入①式得y=0.09 mol 故原混合物中Na2O2有0.04 mol,NaHCO3有0.18 mol 盐酸的物质的量浓度为 |

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案