题目内容
13.设阿伏伽德罗常数为NA,则下列说法正确的是( )| A. | 17g羟基(-OH)所含有的电子数是NA | |
| B. | 常温常压下,4g氮气所含有的原子数目为NA | |
| C. | 1 L 0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| D. | 标准状况下,22.4L乙醇的分子数为NA |
分析 A、求出羟基的物质的量,然后根据羟基不显电性来分析;
B、氮气由氮原子构成;
C、乙酸是弱电解质,不能完全电离;
D、标况下,乙醇为液态.
解答 解:A、17g羟基的物质的量为1mol,而羟基不显电性,故1mol羟基含9mol电子9NA个,故A错误;
B、氮气由氮原子构成,故14g氮气中含有的氮原子的物质的量n=$\frac{14g}{14g/mol}$=1mol,即NA个,故B正确;
C、乙酸是弱电解质,不能完全电离,故溶液中的氢离子的个数小于0.1NA个,故C错误;
D、标况下,乙醇为液态,故其物质的量不能根据气体摩尔体积来计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
3.环己酮是如图1种重要的化工原料、有机溶剂.
设计下列实验制备环己酮:
实验原理利用环己醇可在重铬酸钾溶液中氧化制得(副产物省略):
副产物可能有己二酸(HOOCCH2CH2CH2CH2COOH)等.可能用到的有关数据如下:
制备粗产品:
准确称取10.0g环己醇装于一只大烧杯里,分三次加入6g重铬酸钾和3mL浓硫酸,每加一次都要振摇混匀,并控制反应温度在55~60℃.反应约30min后温度开始下降,再放置15min,其间不断振荡,使反应液呈墨绿色为止.
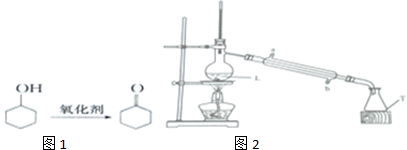
提纯产品:
步骤1:向反应液中加入适量蒸馏水,按下列装置如2行水蒸气蒸馏.
步骤2:收集所有馏出液,向馏出液中加入饱和食盐水,分液得到有机物.
步骤3:用乙醚萃取水溶液中有机物,将萃取液合并于有机化合物中.
步骤4:将有机混合物再装于下列装置L中,加入适量生石灰,再蒸馏,收集151~155℃馏分,得到产品6.5g.
请回答下列问题:
(1)重铬酸钾是强氧化剂,分批加入的目的是减少副产物生成.制备产品温度控制在55~60℃,应选择的加热方式是水浴加热(填“直接加热”或“水浴加热”).
(2)在提纯产品的步骤3中用乙醚萃取水溶液中有机物,其目的是减少产品损失.
(3)在分馏中,如果用烧杯替代T仪器,产率可能会偏低( 填“偏高”“偏低”或“无影响”,下同),如果用氯化钙替代生石灰,产率可能会偏高,如果温度计水银球高于支管口,产率可能会偏高.
(4)在实验过程中,是先B后A(填“A”或“B”,A为加热酒精灯,B为通冷凝水),冷凝管中进水口是b(填“a”或“b”),加热之前,应在L烧瓶中加入几块碎瓷片,其目的是防液体暴沸.
(5)设计一个简单实验证明含少量环己醇杂质的产品中是否有己二酸:取产品于试管,加入蒸馏水,再加入碳酸氢钠溶液,弱产生气泡,则含有己二酸.否则,不含己二酸(写出步骤、现象和结论).
(6)根据上述数据,计算本实验产率为B.
A.65.0% B.66.3% C.68.6% D.70.2%
设计下列实验制备环己酮:
实验原理利用环己醇可在重铬酸钾溶液中氧化制得(副产物省略):
副产物可能有己二酸(HOOCCH2CH2CH2CH2COOH)等.可能用到的有关数据如下:
| 相对分子量 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 26 | 161 | 微溶于水 |
| 环己酮 | 0.8102 | 0.8102 | -45 | 155.6 | 微溶于水 |
准确称取10.0g环己醇装于一只大烧杯里,分三次加入6g重铬酸钾和3mL浓硫酸,每加一次都要振摇混匀,并控制反应温度在55~60℃.反应约30min后温度开始下降,再放置15min,其间不断振荡,使反应液呈墨绿色为止.

提纯产品:
步骤1:向反应液中加入适量蒸馏水,按下列装置如2行水蒸气蒸馏.
步骤2:收集所有馏出液,向馏出液中加入饱和食盐水,分液得到有机物.
步骤3:用乙醚萃取水溶液中有机物,将萃取液合并于有机化合物中.
步骤4:将有机混合物再装于下列装置L中,加入适量生石灰,再蒸馏,收集151~155℃馏分,得到产品6.5g.
请回答下列问题:
(1)重铬酸钾是强氧化剂,分批加入的目的是减少副产物生成.制备产品温度控制在55~60℃,应选择的加热方式是水浴加热(填“直接加热”或“水浴加热”).
(2)在提纯产品的步骤3中用乙醚萃取水溶液中有机物,其目的是减少产品损失.
(3)在分馏中,如果用烧杯替代T仪器,产率可能会偏低( 填“偏高”“偏低”或“无影响”,下同),如果用氯化钙替代生石灰,产率可能会偏高,如果温度计水银球高于支管口,产率可能会偏高.
(4)在实验过程中,是先B后A(填“A”或“B”,A为加热酒精灯,B为通冷凝水),冷凝管中进水口是b(填“a”或“b”),加热之前,应在L烧瓶中加入几块碎瓷片,其目的是防液体暴沸.
(5)设计一个简单实验证明含少量环己醇杂质的产品中是否有己二酸:取产品于试管,加入蒸馏水,再加入碳酸氢钠溶液,弱产生气泡,则含有己二酸.否则,不含己二酸(写出步骤、现象和结论).
(6)根据上述数据,计算本实验产率为B.
A.65.0% B.66.3% C.68.6% D.70.2%
1.PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:
(Ⅰ)制备:
如图是实验室制备PCl3的装置(部分仪器已省略)

(1)仪器乙的名称为冷凝管,其中与自来水进水管连接的编号是b(填“a”或“b”).
(2)实验室常用软锰矿(MnO2)与浓盐酸制备Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)碱石灰的作用是碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度.
(4)向仪器甲中通入干燥的Cl2之前,应先通入一段时间的CO2,其目的是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(Ⅱ)提纯:
(5)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到PCl3的纯品.
(Ⅲ)分析:
(6)迅速称取5.5g产品,水解完全后配成500mL溶液,取出25mL,加入过量的0.1mol•L-1碘溶液23mL,充分反应后用0.1mol•L-1Na2S2O3溶液滴定过量的碘,消耗10mLNa2S2O3溶液.
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;
假设测定过程中没有发生其他反应.根据上述数据,可计算出该产品中PCl3的质量分数为90.0%.
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3 2P+5Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)

(1)仪器乙的名称为冷凝管,其中与自来水进水管连接的编号是b(填“a”或“b”).
(2)实验室常用软锰矿(MnO2)与浓盐酸制备Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)碱石灰的作用是碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度.
(4)向仪器甲中通入干燥的Cl2之前,应先通入一段时间的CO2,其目的是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(Ⅱ)提纯:
(5)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到PCl3的纯品.
(Ⅲ)分析:
(6)迅速称取5.5g产品,水解完全后配成500mL溶液,取出25mL,加入过量的0.1mol•L-1碘溶液23mL,充分反应后用0.1mol•L-1Na2S2O3溶液滴定过量的碘,消耗10mLNa2S2O3溶液.
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;
假设测定过程中没有发生其他反应.根据上述数据,可计算出该产品中PCl3的质量分数为90.0%.
8.下列物质中既存在离子键又存在共价键的是( )
| A. | K2S | B. | NaOH | C. | SiO2 | D. | CO2 |
2. TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )
TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )
 TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )
TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )| A. | TNT分子式为C7H3O6N3 | |
| B. | TNT的名称叫2,4,6-三硝基甲苯 | |
| C. | 每个TNT分子中可共平面的碳原子最多为6个 | |
| D. | 若硝酸的结构可表示为HO-NO2,每摩尔甲苯可取代3mol硝基制得TNT |
3.下列有机化合物的名称中,不正确的是( )
| A. | 2-甲基丁烷 | B. | 3,3-二甲基-1-丁烯 | ||
| C. | 4-甲基-2-戊烯 | D. | 2-甲基-3-丙醇 |

 B.
B.
 D.
D.