题目内容
6.现有下列热化学方程式:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H3=-890kJ•mol-1
④CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H4=-1 367kJ•mol-1
下列说法正确的是( )
| A. | CO(g)的燃烧热比C(s)的燃烧热大 | |
| B. | △H4>△H3>△H2>△H1 | |
| C. | CO(g)具有的能量比CO2(g)高 | |
| D. | 1 mol C2H5OH蒸气完全燃烧生成CO2和液态水,放出大于1 367 kJ的热量 |
分析 A、1mol碳完全燃烧放出的热量多于1mol一氧化碳完全燃烧放出的热,
B、数值为负值比较大小;
C、一氧化碳和氧气总能量高于二氧化碳,但一氧化碳能量不一定高于二氧化碳;
D、气态 C2H5OH变化为液体放热;
解答 解:A、1mol碳完全燃烧放出的热量393.5kJ,1mol一氧化碳完全燃烧放出的热量283KJ,则CO(g)的燃烧热比C(s)的燃烧热小,故A错误;
B、数值为负值比较大小,△H4<△H3<△H2<△H1,故B错误;
C、一氧化碳和氧气总能量高于二氧化碳,但一氧化碳能量不一定高于二氧化碳,故C错误;
D、气态 C2H5OH变化为液体放热,1 mol C2H5OH蒸气完全燃烧生成CO2和液态水,放出大于1 367 kJ的热量,故D正确;
故选D.
点评 本题考查了化学反应能量变化,燃烧热概念分析,反应热和反应焓变大小比较,掌握基础是解题关键,题目较简单.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
14.铝与稀硫酸的反应中,已知30s末硫酸铝的浓度增加了1.2mol/L,若不考虑反应过程中溶液体积的变化,则30s内生成硫酸铝的平均反应速率是( )
| A. | 0.02 mol/(L•s) | B. | 3.6 mol/(L•s) | C. | 1.2 mol/(L•s) | D. | 0.04mol/(L•s) |
11.已知: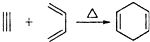 ,如果要合成
,如果要合成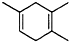 所用的原始原料可以是( )
所用的原始原料可以是( )
①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔.
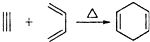 ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔.
| A. | 只有① | B. | ②③ | C. | ②④ | D. | ①④ |
15.2014年8月16日,第二届夏季青年奥林匹克运动会在中国南京开幕.有一种烃分子结构酷似奥林匹克五环旗,科学家称其为奥林匹克烃( ),是由五个苯环相连形成的.下列有关奥林匹克烃的说法正确的是( )
),是由五个苯环相连形成的.下列有关奥林匹克烃的说法正确的是( )
 ),是由五个苯环相连形成的.下列有关奥林匹克烃的说法正确的是( )
),是由五个苯环相连形成的.下列有关奥林匹克烃的说法正确的是( )| A. | 该有机物属于芳香族化合物,是苯的同系物 | |
| B. | 能与溴水发生加成反应 | |
| C. | 能使酸性高锰酸钾溶液褪色 | |
| D. | 该烃的分子式为C22H14 |

 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).