题目内容
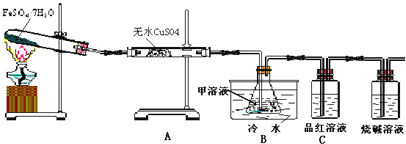
【题目】普通干电池,是一种广泛使用的可移动化学电源,其结构如图甲所示,电池反应是:![]() 但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
实验一、用废锌制取防腐剂皓矾![]() 图乙
图乙![]()
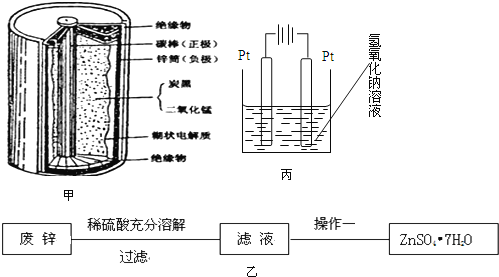
![]() 操作一的名称是:______。
操作一的名称是:______。
![]() 锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物
锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物![]() 四羟基锌酸钠
四羟基锌酸钠![]() 和
和![]() ,该配合物中心离子是______,配位数是 ______。
,该配合物中心离子是______,配位数是 ______。
实验二、经查相关资料:锰的氧化物都不溶于水,且都能与浓盐酸反应生成氯气.将分离得到的黑色粉末在空气中充分灼烧,并做相关实验,回答下列问题:
![]() 灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物
灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物![]() 和
和![]() 。
。
![]() 写出
写出![]() 与浓盐酸反应的离子方程式: ______ 。
与浓盐酸反应的离子方程式: ______ 。
![]() 取
取![]() 上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气
上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气![]() ,则混合物中
,则混合物中![]() 和
和![]() 质量之比是: ______ 。
质量之比是: ______ 。
实验三、查询资料得知,还可以通过电解的方式,将![]() 转化为
转化为![]() ,同学们设计了这样的一个装置
,同学们设计了这样的一个装置![]() 图丙
图丙![]() ,将混合物粉末调成糊状,附在其中的 ______ 边电极上
,将混合物粉末调成糊状,附在其中的 ______ 边电极上![]() 填左或者右
填左或者右![]() ,该电极上发生的电极反应式是: ______
,该电极上发生的电极反应式是: ______ ![]() 在电解过程中溶液的pH将 ______填变大、变小、不变
在电解过程中溶液的pH将 ______填变大、变小、不变![]() 。
。
【答案】蒸发浓缩、冷却结晶 ![]() 4 除去混合物中的碳
4 除去混合物中的碳 ![]() 158:55 左
158:55 左 ![]() 变大
变大
【解析】
实验一:![]() 由流程可知,操作一是由硫酸锌溶液得到晶体;
由流程可知,操作一是由硫酸锌溶液得到晶体;
(2)![]() 由
由![]() 通过配位键与4个OH-结合;
通过配位键与4个OH-结合;
实验二:![]() 分离得到的黑色粉末含有锰的氧化物和碳粉;
分离得到的黑色粉末含有锰的氧化物和碳粉;
(2)![]() 与浓盐酸反应生成氯化锰、氯气和水;
与浓盐酸反应生成氯化锰、氯气和水;
(3)根据电子守恒计算![]() 和
和![]() 物质的量比;
物质的量比;
实验三:![]() 转化为
转化为![]() 发生氧化反应,混合物附在阳极上,根据总反应判断pH变化;
发生氧化反应,混合物附在阳极上,根据总反应判断pH变化;
实验一:![]() 由流程可知,由硫酸锌溶液得到晶体,则操作一为蒸发浓缩、冷却结晶;
由流程可知,由硫酸锌溶液得到晶体,则操作一为蒸发浓缩、冷却结晶;
![]() 配合物
配合物![]() 中,
中, ![]() 由
由![]() 通过配位键与4个OH-结合,
通过配位键与4个OH-结合,![]() 为中心离子,
为中心离子,![]() 为配体,配位数为4;
为配体,配位数为4;
实验二:![]() 混合物灼烧时C转化为二氧化碳气体,与固体分离,所以灼烧的目的是除去混合物中的碳;
混合物灼烧时C转化为二氧化碳气体,与固体分离,所以灼烧的目的是除去混合物中的碳;
![]() 与浓盐酸反应,生成氯化锰、氯气和水,离子反应为
与浓盐酸反应,生成氯化锰、氯气和水,离子反应为![]() ;
;
![]() 设
设![]() 和
和![]() 的物质的量分别为x、y,则
的物质的量分别为x、y,则
由质量关系可知![]() ,
,
由电子守恒可知,![]() ,
,
解得![]() ,物质的量相同,可知摩尔质量之比等于质量比,则
,物质的量相同,可知摩尔质量之比等于质量比,则![]() 和
和![]() 质量比为158:55;
质量比为158:55;
实验三:通过电解的方式,将![]() 转化为
转化为![]() ,在阳极上失去电子实现转化,由图可知,左侧与电源正极相连为阳极,则将混合物粉末调成糊状,附在其中的左边电极上,该电极上发生的电极反应式是:
,在阳极上失去电子实现转化,由图可知,左侧与电源正极相连为阳极,则将混合物粉末调成糊状,附在其中的左边电极上,该电极上发生的电极反应式是:![]() ,阴极氢离子放电,
,阴极氢离子放电,![]() ,总反应消耗水,最终氢氧根离子浓度增大,则在电解过程中溶液的pH将变大。
,总反应消耗水,最终氢氧根离子浓度增大,则在电解过程中溶液的pH将变大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案