题目内容
3.下列有关电化学装置完全正确的是( )| A. | 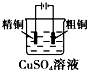 铜的冶炼 | B. | 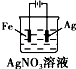 铁上镀银 | C. | 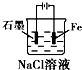 防止Fe被腐蚀 | D. | 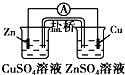 构成铜锌原电池 |
分析 A、铜的冶炼,粗铜的精炼中粗铜作阳极;
B、铁片镀银,铁片应作阴极;
C、电解池中阴极被保护;
D、含有盐桥的原电池中,同一半反应装置中电极材料和电解质溶液中的金属阳离子是相同的元素.
解答 解:A、与电源负极相连的为阴极,粗铜的精炼中粗铜作阳极,由图可知,粗铜作阴极,故A错误;
B、铁片镀银,铁片应作阴极,银座阳极,硝酸银做电解质溶液,图中铁做阳极,故B错误;
C、铁做电解池的阴极,被保护,故C正确;
D、该装置中,同一半反应装置中电极材料和电解质溶液中的金属阳离子不是相同的元素,故D错误;
故选C.
点评 本题考查原电池与电解原理的应用,明确正负极与阴阳极的判断及发生的电极反应是解答本题的关键,注意电解池中如果较活泼的金属作阳极,电解池工作时,阳极上金属失电子而不是溶液中阴离子失电子,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列说法中,正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量时,反应为放热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,即△H>0,反应吸热 | |
| D. | △H的大小与热化学方程式的化学计量数无关 |
14.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
(1)氨基甲酸铵(NH2COONH4)分解反应平衡常数K的表达式为K=c2(NH3)•c(CO2).
(2)判断氨基甲酸铵分解反应的△H>0(填“>”、“<”或“=”),其原因是什么?由表格中,数据可知:升高温度,气体的平衡总浓度增大,平衡正向移动,故△H>0
(3)判断氨基甲酸铵分解反应的△S>_0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?高温下反应能自发进行.
(4)升高温度,化学平衡常数K如何变化?增大,增大容器的压强,K值如何变化?不变.(填“变大”“变小”或“不变”).
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数1.6×10-8.
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是C
A.2v(NH3)=v(CO2) B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变.
NH2COONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 | |||||
| (×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(2)判断氨基甲酸铵分解反应的△H>0(填“>”、“<”或“=”),其原因是什么?由表格中,数据可知:升高温度,气体的平衡总浓度增大,平衡正向移动,故△H>0
(3)判断氨基甲酸铵分解反应的△S>_0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?高温下反应能自发进行.
(4)升高温度,化学平衡常数K如何变化?增大,增大容器的压强,K值如何变化?不变.(填“变大”“变小”或“不变”).
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数1.6×10-8.
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是C
A.2v(NH3)=v(CO2) B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变.
11.在一个密闭容器中进行如下反应:2X2(g)+Y2(g)?2Z(g),反应过程中某一时刻X2、Y2、Z的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1.当反应达到平衡时,下列数据可能合理的是( )
| A. | Z的浓度为0.4 mol•L-1 | B. | X2、Z的浓度均为0.15 mol•L-1 | ||
| C. | X2与Z的浓度之和为0.4 mol•L-1 | D. | X2的浓度为0.4 mol•L-1 |
18.下列物质的水溶液能导电,但不属于电解质的化合物是( )
| A. | SO3 | B. | Cl2 | C. | NH4NO3 | D. | HNO3 |
8.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A. | 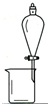 用CCl4提取溴水中的Br2 用CCl4提取溴水中的Br2 | B. | 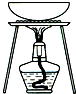 从KI和I2的固体混合物中回收I2 从KI和I2的固体混合物中回收I2 | ||
| C. | 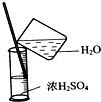 稀释浓硫酸 稀释浓硫酸 | D. | 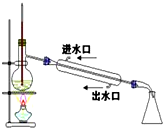 工业酒精制备无水酒精 工业酒精制备无水酒精 |
15.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3、H2S、CO2 | B. | H2O、NH3•H2O、HClO | ||
| C. | H2SO3、Ba(OH)2、BaSO4 | D. | Cu(OH)2CH3COOH、C2H5OH、CH3COONa |
