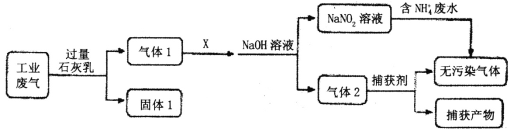
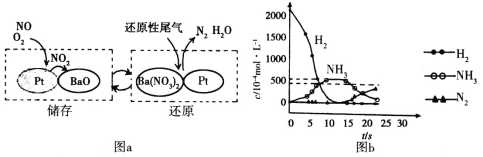
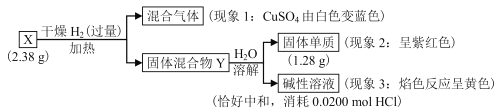
题目内容
【题目】Ge、Na及其化合物在航空航天、电子工业上有重要应用。请回答下列问题:
(1)基态Ge原子价层电子的排布式为___,其电子填充的最高能级的轨道数为___。电子占据最高能级的电子云轮廓图为___形。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是___。
(3)硼氢化钠(NaBH4)是有机化学中的一种常用还原剂,[BH4]-的空间构型是__,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)NaC1是离子晶体,其晶格能可通过下图的循环计算得到。
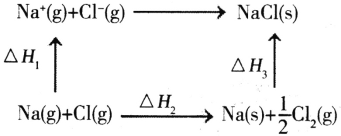
△H(晶格能)=___。
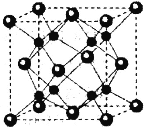
(5)Na2O的立方晶胞如图所示,氧离子采取面心立方堆积,钠离子填在由氧离子形成的__空隙中。已知晶胞边长a=0.566nm,晶胞中O原子的配位数为__;该晶体的密度是___g·cm-3(列出计算表达式)。
【答案】4s24p2 3 纺锤(或哑铃) 锗元素原子半径大,难以通过“肩并肩”方式形成π键 正四面体 sp3 AB △H1-△H2-△H3 四面体 8 ![]()
【解析】
(1)Ge是32号元素,有4个价电子,根据核外电子排布规律书写电子排布图,其电子填充的最高能级为4p能级,它的轨道数为3,形状为纺锤(或哑铃)。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,它们属于同族元素,半径逐渐增大,难以形成双键。
(3) [BH4]-单位空间构型要算孤电子对数和成键电子对数,相加算出价层电子对数,由于没有孤对电子,得到VSEPR模型就是该分子的立体构型,为正四面体,[BH4]-中B原子孤电子对数=![]() =0,价层电子对数=4+0=4,VSEPR模型为正四面体,没有孤电子对,空间构型为正四面体,价层电子对数为4,则杂化方式为sp3,根据NaBH4的晶体类型,可判断出晶体中含有共价键(σ键)和离子键。
=0,价层电子对数=4+0=4,VSEPR模型为正四面体,没有孤电子对,空间构型为正四面体,价层电子对数为4,则杂化方式为sp3,根据NaBH4的晶体类型,可判断出晶体中含有共价键(σ键)和离子键。
(4)利用晶格能的定义和盖斯定律算出△H ,
①Na(g)+Cl(g)= Na+(g)+Cl(g)△H1
②Na(g)+Cl(g)= Na(s)+![]() Cl2(g) △H2
Cl2(g) △H2
③Na(s)+![]() Cl2(g)= NaCl(s) △H3
Cl2(g)= NaCl(s) △H3
②+③-①可得:Na+(g)+Cl(g)= NaC1(s),由气态变为固态为放热,△H<0算出△H=-(△H1-△H2-△H3),故晶格能为△H1-△H2-△H3。
(5)Na2O晶胞中阴离子O2-位于晶胞的顶点和面心,阳离子Na+位于晶胞的体心,根据晶胞的结构判断配位数,O2-半径大于Na+,据此计算质量和体积,进而计算密度。
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为[Ar]3d104s24p2;原子价层电子的排布式为4s24p2,其电子填充的最高能级4p,4p能级有三个轨道,4p轨道是哑铃型或纺锤形的,
故答案为 4s24p2;3 ;纺锤(或哑铃);
(2)Ge原子半径大,难以通过“肩并肩”方式形成π键,
答案为:锗元素原子半径大,难以通过“肩并肩”方式形成π键;
(3) [BH4]-中B原子孤电子对数=![]() =0,价层电子对数=4+0=4,VSEPR模型为正四面体,没有孤电子对,空间构型为正四面体,B原子杂化方式为:sp3,Na+、[BH4]-离子之间形成离子键,[BH4]-中B原子与H原子之间形成普通共价键、配位键,均属于σ键,
=0,价层电子对数=4+0=4,VSEPR模型为正四面体,没有孤电子对,空间构型为正四面体,B原子杂化方式为:sp3,Na+、[BH4]-离子之间形成离子键,[BH4]-中B原子与H原子之间形成普通共价键、配位键,均属于σ键,
故答案为:正四面体;sp3;AB;
(4)晶格能是指在标准状况下,使离子晶体变成气态正离子和气态负离子时所吸收的能量NaCl晶格能是Na+、Cl气态离子形成1molNaCl晶体释放的能量,故NaCl的晶格能
根据图示,需求出Na+(g)+Cl(g)= NaC1(s)的焓变,就是晶格能,
已知①Na(g)+Cl(g)= Na+(g)+Cl(g)△H1
②Na(g)+Cl(g)= Na(s)+![]() Cl2(g) △H2
Cl2(g) △H2
③Na(s)+![]() Cl2(g)= NaCl(s) △H3
Cl2(g)= NaCl(s) △H3
②+③-①可得:Na+(g)+Cl(g)= NaCl(s) ,由气态变为固态为放热,△H<0,则△H=-(△H1-△H2-△H3),故晶格能为△H1-△H2-△H3,
故答案为:△H1-△H2-△H3;
(5)Na2O晶胞中阴离子O2-位于晶胞的顶点和面心,阳离子Na+位于晶胞的体心,从图中可以得知,钠离子填在由氧离子成的四面体空隙中,根据晶胞的结构判断配位数,Na+的个数为8,O2-的个数为8×![]() +6×
+6×![]() =4,据此计算质量和体积,进而计算密度.晶胞中O位于顶点,Na位于体心,每个晶胞中有1个Na与O的距离最近,每个定点为8个晶胞共有,则晶胞中O原子的配位数为8,Na的个数为8,O的个数为8×
=4,据此计算质量和体积,进而计算密度.晶胞中O位于顶点,Na位于体心,每个晶胞中有1个Na与O的距离最近,每个定点为8个晶胞共有,则晶胞中O原子的配位数为8,Na的个数为8,O的个数为8×![]() +6×
+6×![]() =4,晶胞的质量为=
=4,晶胞的质量为=![]() =
=![]() ,晶胞的体积为(0.566×107)3cm3,则晶体的密度为=
,晶胞的体积为(0.566×107)3cm3,则晶体的密度为=![]() =
=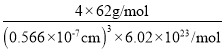 ,
,
答案为:四面体;8; ![]() 。
。

【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
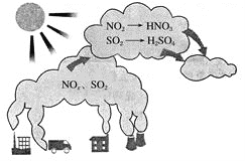
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤