题目内容
【题目】(1)已知:①甲烷的燃烧热为 ΔH=—890.3 kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=—517.6 kJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH=—566kJ/mol
甲烷在一定条件下与CO2反应制备合成气(CO、H2),能实现变废为宝,减少CO2的排放,该反应的热化学方程式为_____________________________________________
(2)燃料电池是应用广泛的新型电池,分析下列燃料电池示意图,按要求书写出电极反应式
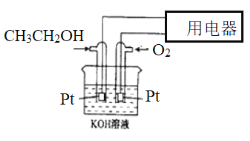
①正极的电极反应式____________________________________________;
②电解质溶液的pH_____________(填“增大”、“减小”或“不变”);
③当电路中转移0.4mol电子时,理论上消耗标准状况下O2的体积为__________L。
【答案】CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+193.3kJ/molO2+4e-+2H2O=4OH-减小2.24
【解析】
(1)由甲烷的燃烧热为 ΔH=—890.3 kJ/mol可得热化学反应方程式①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3kJ·mol-1,联立②③运用盖斯定律①-②-③可得目标热化学反应方程式为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+193.3kJ/mol;(2) ①通入氧气的一极为燃料电池的正极,其电极反应式为:O2+4e-+2H2O=4OH-;②由于燃料电池在工作过程中不断产生水和CO2,从而消耗了OH-,故溶液的pH不断减小;③由正极反应可得每转移0.4mol电子,消耗0.1mol氧气,故理论上消耗标准状况下O2的体积为2.24L。

 互动英语系列答案
互动英语系列答案