题目内容
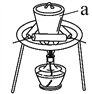
【题目】室温下将40 g已磨成粉末的Ba(OH)28H2O和20 g NH4Cl置于250 mL锥形瓶中,迅速搅拌将固体药品混合均匀,20 s后用带有玻璃管的单孔橡皮塞塞紧瓶口,玻璃管口悬挂一湿润的红色石蕊试纸,如图所示。试回答:
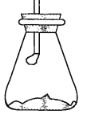
(1)湿润的红色石蕊试纸的变化是________,用化学方程式作出相关解释_______。
(2)若将锥形瓶中的Ba(OH)28H2O和NH4Cl换成__________,也可出现装置内温度降低的现象。
【答案】变蓝Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;NH3+H2O![]() NH3H2O
NH3H2O![]() NH4+ +OH-硝酸铵固体和水
NH4+ +OH-硝酸铵固体和水
【解析】
(1)Ba(OH)28H2O和NH4Cl反应生成NH3,NH3溶于水生成一水合氨,一水合氨电离出铵根和氢氧根离子,溶液显碱性,能够使湿润的红色石蕊试纸变蓝,有关的方程式为Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;NH3+H2O![]() NH3H2O
NH3H2O![]() NH4+ +OH-。
NH4+ +OH-。
(2)由于硝酸铵溶于水也吸热,则将锥形瓶中的Ba(OH)28H2O和NH4Cl换成硝酸铵固体和水,也可出现装置内温度降低的现象。

【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
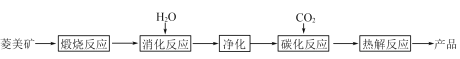
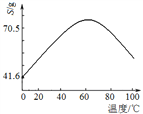
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()