题目内容
硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学设计了如下装置利用中学实验室常见试剂制取NH3,并以空气、NH3为原料模拟工业制HNO3(三氧化二铬为催化剂,加热及夹持装置未画出):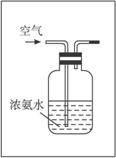
回答下列问题:
(1)写出A中反应的化学方程式_________________,实验时,A、C两装置均需加热,应先加热_________________装置,原因是__________________________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是________________________。
(3)E装置的作用是_________________,F、G装置中的物质分别是_________________。
(4)若保留上图中黑色粗线框中的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中划出装置图并注明所用药品的名称)。

解析:此题主要考查氨的实验室制法和氨的催化氧化法制取硝酸,关键的一步反应就是氨的催化氧化,为了提高氨气的转化率要先对C装置加热,为了不影响硝酸的生成需要把没有反应的氨气除去,并且要有安全瓶防止F中的液体倒吸,氮氧化物是大气污染物,所以要有尾气吸收装置。制取氨气也可以利用氨水的挥发性。
答案:(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
C 使催化剂达到适宜温度,提高NH3的转化率
(2)P2O5或无水CaCl2 除去C中未反应的氨气
(3)安全瓶,防止倒吸 水、NaOH溶液
(4)

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
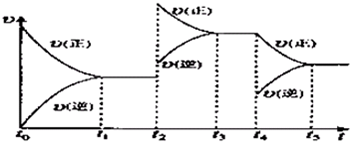
 Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0