题目内容
下列关于各溶液的描述中正确的是( )
| A、pH相等的①NH4Cl ②(NH4) 2SO4③NH4HSO4的溶液中,c(NH4+)大小:①>②>③ |
| B、向1.00L0.3mol?L-l的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中:3c (Na+)=2[c(HCO3-)+C (CO32-)+c(H2CO3)] |
| C、浓度均为0.1 mol?L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c (CH3COOH)=c (H+)-c(OH-) |
| D、常温下,在l0mL pH=12的氢氧化钠溶液中加入pH=2的HA酸至pH刚好等于7,所得溶液体积V(总)≤20mL |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A.氢离子抑制铵根离子水解,相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等;
B.向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,根据物料守恒判断;
C.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.常温下,pH=12的NaOH溶液浓度为0.01mol/L,pH=2的HA可能是强酸、也可能是弱酸,则c(HA)≥0.01mol/L.
B.向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,根据物料守恒判断;
C.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.常温下,pH=12的NaOH溶液浓度为0.01mol/L,pH=2的HA可能是强酸、也可能是弱酸,则c(HA)≥0.01mol/L.
解答:
解:A.相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,所以c(NH4+)大小:①=②>③,故A错误;
B.向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,根据物料守恒得2c (Na+)=3[c(HCO3-)+C (CO32-)+c(H2CO3)],故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),所以得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),则c(CH3COO-)-c (CH3COOH)=2c (H+)-2c(OH-),故C错误;
D.常温下,pH=12的NaOH溶液浓度为0.01mol/L,pH=2的HA可能是强酸、也可能是弱酸,则c(HA)≥0.01mol/L,如果是强酸,要使溶液呈中性,则酸碱体积相等,如果是弱酸,要使溶液呈中性,酸的体积应该稍微小些,所以溶液总体积V(总)≤20mL,故D正确;
故选D.
B.向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,根据物料守恒得2c (Na+)=3[c(HCO3-)+C (CO32-)+c(H2CO3)],故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),所以得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),则c(CH3COO-)-c (CH3COOH)=2c (H+)-2c(OH-),故C错误;
D.常温下,pH=12的NaOH溶液浓度为0.01mol/L,pH=2的HA可能是强酸、也可能是弱酸,则c(HA)≥0.01mol/L,如果是强酸,要使溶液呈中性,则酸碱体积相等,如果是弱酸,要使溶液呈中性,酸的体积应该稍微小些,所以溶液总体积V(总)≤20mL,故D正确;
故选D.
点评:本题考查离子浓度大小比较,涉及盐类水解、弱电解质的电离、酸碱混合溶液定性判断等知识点,明确溶液中的溶质再利用守恒思想分析解答即可,题目难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
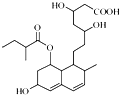 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A、能与FeCl3溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、1mol该物质与足量钠发生反应生成4molH2 |
| D、1mol该物质最多可与1molNaOH反应 |
下列物质中属于有机高分子化合物的是( )
| A、乙醇 | B、蛋白质 |
| C、阿斯匹林 | D、蔗糖 |
工业上制取硫酸,回收尾气中的废气常选用的试剂是( )
| A、氨水 |
| B、NaOH |
| C、H2SO4 |
| D、H2SO3 |
 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4