题目内容
13.丙烯酸是重要的有机合成原料,其结构简式为CH2=CH-COOH.下列关于丙烯酸的说法错误的是( )| A. | 能发生加成反应和加聚反应 | B. | 水溶液能使pH试纸变红 | ||
| C. | 是乙酸的一种同系物 | D. | 所有原子可能处于同一平面 |
分析 由结构可知,分子中含碳碳双键、-COOH,结合烯烃、羧酸的性质来解答.
解答 解:A.含碳碳双键,能发生加成反应和加聚反应,故A正确;
B.含-COOH,具有酸性,水溶液能使pH试纸变红,故B正确;
C.含碳碳双键,与乙酸结构不相似,不互为同系物,故C错误;
D.碳碳双键、羰基均为平面结构,则所有原子可能处于同一平面,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、羧酸的性质应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.某元素X的核外电子数等于核内中子数,取该元素单质2.8克与氧充分作用,可得到6克化合物XO2.下列说法正确的是( )
| A. | 该元素位于第2周期 | |
| B. | 该元素位于第VI A族 | |
| C. | 该元素的氢化物溶于水显碱性 | |
| D. | 该元素最高价氧化物的水化物是一种弱酸 |
4.室温时,下列溶液等体积混合后pH一定小于7的是( )
| A. | pH=3的盐酸和pH=11的氨水 | |
| B. | pH=3的盐酸和pH=11的氢氧化钡溶液 | |
| C. | pH=3的硫酸和pH=11的氨水 | |
| D. | pH=3的醋酸和pH=11的氢氧化钡溶液 |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温下,1 L pH=12的Ba(OH)2溶液中含有的OH-离子数为0.02 NA | |
| B. | 1L 0.1 mol•L-1的NaClO溶液中ClO-数目为0.1NA | |
| C. | 密闭容器中0.1 mol N2与0.3 mol H2一定条件进行反应,生成氨分子数目为0.2 NA | |
| D. | 标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数为0.1NA |
5.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法中正确的是( )
| A. | KClO3在反应中是还原剂 | |
| B. | 1molKClO3参加反应,在标准状况下能得到22.4L气体 | |
| C. | 反应中H2C2O4既不是氧化剂也不是还原剂 | |
| D. | 1molKClO3参加反应有1mol电子转移 |
2.能够大量共存的离子组合是( )
| A. | H+、SO42-、NO3-、Ba2+ | B. | K+、Cl-、CO32-、Na+ | ||
| C. | Cu2+、NO3-、OH-、Na+ | D. | K+、SO42-、HCO3-、H+ |
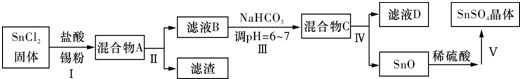
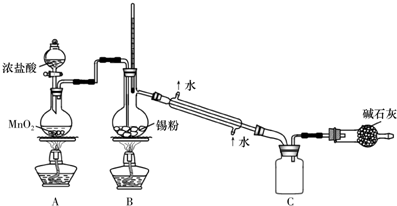
 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质, .
. ;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.
;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.