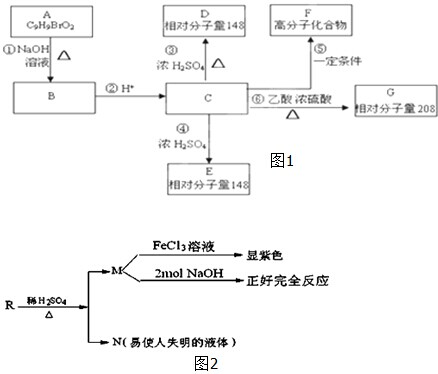
题目内容
将21.2g的Na、Al、Fe三种金属的混合物分为两等份,一份加入到足量的盐酸中充分反应后得到标准状况下的氢气6.72L;再将另一份金属混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气4.48L.求原金属混合物中Na、Al、Fe三种金属的物质的量之比.
考点:化学方程式的有关计算
专题:
分析:Na、Al、Fe三种金属都能够与盐酸反应生成氢气;产生氢气的量的关系为:Na~
H2↑,Al~
H2↑,Fe~H2↑;
Na、Al、Fe三种金属加入到足量的NaOH溶液中,钠与水反应生成氢气,产生氢气的量的关系为:Na~
H2↑,
铝与氢氧化钠反应生成氢气,Al~
H2↑,铁不反应;
设三种金属的物质的量分别为Na xmol Al ymol Fe zmol,依据两种情况下产生氢气的物质的量计算三种金属的物质的量解答.
| 1 |
| 2 |
| 3 |
| 2 |
Na、Al、Fe三种金属加入到足量的NaOH溶液中,钠与水反应生成氢气,产生氢气的量的关系为:Na~
| 1 |
| 2 |
铝与氢氧化钠反应生成氢气,Al~
| 3 |
| 2 |
设三种金属的物质的量分别为Na xmol Al ymol Fe zmol,依据两种情况下产生氢气的物质的量计算三种金属的物质的量解答.
解答:
解:Na、Al、Fe三种金属的混合物质量为21.2g,所以:23x+27y+56z=21.2g;
Na、Al、Fe三种金属加入到足量的盐酸中充分反应后得到标准状况下的氢气6.72L即物质的量为
=0.3mol,则:0.5×x×
+
×1.5y+
z=0.3mol;
Na、Al、Fe三种金属加入足量的NaOH溶液中,充分反应后得到标准状况下的氢气4.48L即物质的量为
=0.2mol,则:0.5×x×
+
×1.5y=0.2mol;
解得x=0.2mol;y=0.2mol;z=0.2mol;
所以Na、Al、Fe三种金属的物质的量之比=0.2mol:0.2mol:0.2mol=1:1:1;
故答案为:1:1:1.
Na、Al、Fe三种金属加入到足量的盐酸中充分反应后得到标准状况下的氢气6.72L即物质的量为
| 6.72L |
| 22.4L/mpl |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
Na、Al、Fe三种金属加入足量的NaOH溶液中,充分反应后得到标准状况下的氢气4.48L即物质的量为
| 4.48L |
| 22.4l/mol |
| 1 |
| 2 |
| 1 |
| 2 |
解得x=0.2mol;y=0.2mol;z=0.2mol;
所以Na、Al、Fe三种金属的物质的量之比=0.2mol:0.2mol:0.2mol=1:1:1;
故答案为:1:1:1.
点评:本题考查了有关方程式的计算,明确钠、铝、铁的性质及发生的反应是解题关键,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断正确的是( )
| A、含乙元素的化合物数目比含甲、丙元素的化合物数目多 |
| B、甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 |
| C、原子半径由大到小的顺序为丙>甲>乙 |
| D、乙元素的族序数比甲元素的族序数小 |
有关物质与反应分类的下列说法中,正确的是( )
| A、硅酸钠是钠盐,也是硅酸盐 |
| B、碳酸钠使无色酚酞试液变红,属于碱 |
| C、CO2溶于水能导电,属电解质 |
| D、CO还原氧化铁获得铁,属于置换反应 |
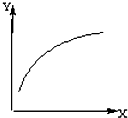 在密闭容器中加入A、B两种物质,在一定条件下反应:2A(s)+B(g)?2C(g) (△H<0).达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中加入A、B两种物质,在一定条件下反应:2A(s)+B(g)?2C(g) (△H<0).达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )