题目内容
7.胶体区别于其它分散系最本质的特征是( )| A. | 外观澄清、透明 | B. | 胶体粒子直径在1~100nm之间 | ||
| C. | 能产生丁达尔现象 | D. | 外观澄清、不透明 |
分析 胶体分散系与其它分散系的本质差别是分散质直径的大小不同.
解答 解:胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm之间,溶液的分散质粒子直径小于1nm,浊液的分散质粒子直径大于100nm.
故选B.
点评 本题考查胶体的判断,注意胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm之间,题目难度不大.

练习册系列答案
相关题目
17.化学学科中的平衡理论包括:化学平衡、电离平衡、溶解平衡等,且均符合勒夏特列原理.请回答下列问题:
I、在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$.已知:K300℃>K350℃,则该反应是放热反应.
(2)如图1中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.

(3)能说明该反应已达到平衡状态的是BE.
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2 D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向正反应方向移动(填“正”或“逆”),K值不变(填“增大”、“减小”或“不变”)
II、一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)△H>0,起始时,c(A)=0.2mol/L,c(B)=0.6mol/L,c(C)=0.4mol/L.当平衡时,下列数据可能存在的是bc.
a.c(A)=0.4mol/L b.c(B)=1.0mol/L
c.c(A)=0.3mol/L且c(C)=0.2mol/L d.c(C)=1.0mol/L
III、常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图2所示,则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1<m2(选填“<”、“=”、“>”).
I、在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图1中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.

(3)能说明该反应已达到平衡状态的是BE.
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2 D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向正反应方向移动(填“正”或“逆”),K值不变(填“增大”、“减小”或“不变”)
II、一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)△H>0,起始时,c(A)=0.2mol/L,c(B)=0.6mol/L,c(C)=0.4mol/L.当平衡时,下列数据可能存在的是bc.
a.c(A)=0.4mol/L b.c(B)=1.0mol/L
c.c(A)=0.3mol/L且c(C)=0.2mol/L d.c(C)=1.0mol/L
III、常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图2所示,则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1<m2(选填“<”、“=”、“>”).
18.配制NH4Cl溶液时,为了使NH4+浓度与Cl-的浓度比达到1:1,可加入( )
| A. | 适量的HCl | B. | 适量的NaCl | C. | 适量的氨水 | D. | 适量的NaOH |
2.下列表示0.1mol/L NaHCO3溶液中有关微粒浓度(mol/L)的关系式中,正确的是( )
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(CO${\;}_{3}^{2-}$)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| C. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | c(Na+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(H2CO3) |
12.可用分液漏斗分离的一组混合物是( )
| A. | 苯和酒精 | B. | 四氯化碳和溴 | C. | 苯和水 | D. | 醋酸和水 |
19.下列说法中不正确的是( )
| A. | 在标准状况下,氯气的密度约为3.17g/L | |
| B. | 密闭容器中的氯水放置数天后,pH变小且几乎失去漂白性 | |
| C. | 液氯具有漂白性,干燥的氯气和液氯均能使干燥的有色布条褪色 | |
| D. | 在通常情况下,氯气可以和某些金属直接化合 |
16.下列实验操作正确的是( )
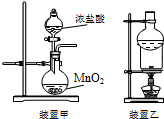

| A. | 用装置甲可以制备氯气 | |
| B. | 用装置乙分离泥沙中的碘单质 | |
| C. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| D. | 用玻璃棒蘸取NaClO溶液点在pH试纸上,测定溶液的pH |
17.下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| B | 氯气中混有氯化氢气体 | 洗气 | 氯气和氯化氢在饱和食盐水中溶解度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离CCl4和碘的混合溶液 | 升华 | CCl4和碘沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
