题目内容
(1)按要求填空:周期表中电负性最大的元素的基态原子核外电子排布式 ;第三周期元素中离子半径最小的元素的价电子排布式 ; Cu2+的电子排布式: .
(2)在下列物质中:①N2、②H2S、③KOH、④MgCl2、⑤C2H4、⑥Na2O2、⑦NH4C1⑧苯(C6H6)(用序号填空)其中只含有非极性键的是 ;只含有离子键的是 ;既含有非极性键又含有极性键的是 ;含有非极性键的离子化合物是 ,上述物质存在范德华力的是 .
(3)短周期元素中,X原子核外L层中只有两对成对电子,Y原子价电子排布为nsnnpn,Z原子最外层电子数比内层电子总数少4,则YX2与 ZX2分子的空间构型依次为 、 .
(2)在下列物质中:①N2、②H2S、③KOH、④MgCl2、⑤C2H4、⑥Na2O2、⑦NH4C1⑧苯(C6H6)(用序号填空)其中只含有非极性键的是
(3)短周期元素中,X原子核外L层中只有两对成对电子,Y原子价电子排布为nsnnpn,Z原子最外层电子数比内层电子总数少4,则YX2与 ZX2分子的空间构型依次为
考点:原子核外电子排布,离子化合物的结构特征与性质,共价键的形成及共价键的主要类型,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:(1)周期表中电负性最大的元素是F元素,根据构造原理书写其基态原子核外电子排布式;第三周期元素中,离子电子层数越少,其离子半径越小,所以离子半径最小的是Al3+;
Cu是29号元素,其原子核外有29个电子,其基态原子核外电子排布式为[Ar]3d104s1,Cu原子失去2个电子变为Cu2+;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,分子晶体中存在范德华力;
(3)短周期元素中,X原子核外L层中只有两对成对电子,则X原子核外有8个电子,则为O元素;Y原子价电子排布为nsnnpn,s能级最多排列2个电子,则Y原子价电子排布式为2s22p2,则Y是C元素;Z原子最外层电子数比内层电子总数少4,则能层电子数为10,其最外层电子数是6,则Z是S元素,根据价层电子对互斥理论确定YX2与 ZX2分子的空间构型.
Cu是29号元素,其原子核外有29个电子,其基态原子核外电子排布式为[Ar]3d104s1,Cu原子失去2个电子变为Cu2+;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,分子晶体中存在范德华力;
(3)短周期元素中,X原子核外L层中只有两对成对电子,则X原子核外有8个电子,则为O元素;Y原子价电子排布为nsnnpn,s能级最多排列2个电子,则Y原子价电子排布式为2s22p2,则Y是C元素;Z原子最外层电子数比内层电子总数少4,则能层电子数为10,其最外层电子数是6,则Z是S元素,根据价层电子对互斥理论确定YX2与 ZX2分子的空间构型.
解答:
解:(1)周期表中电负性最大的元素是F元素,根据构造原理知其基态原子核外电子排布式为1s22s22p5;
第三周期元素中,离子电子层数越少,其离子半径越小,所以离子半径最小的是Al3+,Al原子核外最外层电子数是3且位于第三电子层上,所以Al原子价电子排布式为3s23p1;
Cu是29号元素,其原子核外有29个电子,其基态原子核外电子排布式为[Ar]3d104s1,Cu原子失去2个电子变为Cu2+,Cu2+的电子排布式为[Ar]3d9,
故答案为:1s22s22p5;3s23p1;[Ar]3d9;
(2)①N2中两个N原子之间只存在非极性键,为分子晶体;
②H2S中H原子和S原子之间只存在极性键,为分子晶体;
③KOH中钾离子和氢氧根离子之间存在离子键、H原子和O原子之间存在极性键,为含有极性键的离子化合物;
④MgCl2中镁离子和氯离子之间只存在离子键,为离子化合物;
⑤C2H4中C原子之间存在非极性键、C原子和H原子之间存在极性键,为分子晶体;
⑥Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性键,为离子化合物;
⑦NH4C1中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,为离子化合物;
⑧苯(C6H6)中C原子之间存在非极性键,C原子和H原子之间存在极性键,为分子晶体;
通过以上分析知,其中只含有非极性键的是①;只含有离子键的是④;既含有非极性键又含有极性键的是 ⑤⑧;含有非极性键的离子化合物是⑥,分子晶体中含有范德华力,所以上述物质存在范德华力的是 ①②⑤⑧,
故答案为:①;④;⑤⑧;⑥;①②⑤⑧;
(3)短周期元素中,X原子核外L层中只有两对成对电子,则X原子核外有8个电子,则为O元素;Y原子价电子排布为nsnnpn,s能级最多排列2个电子,则Y原子价电子排布式为2s22p2,则Y是C元素;Z原子最外层电子数比内层电子总数少4,则能层电子数为10,其最外层电子数是6,则Z是S元素,
CO2分子C原子只含2个σ键,则为直线形结构,SO2分子中价层电子对个数=2+
×(6-2×2)=3,且含有1个孤电子对,所以二氧化硫分子为V形结构,
故答案为:直线形;V形.
第三周期元素中,离子电子层数越少,其离子半径越小,所以离子半径最小的是Al3+,Al原子核外最外层电子数是3且位于第三电子层上,所以Al原子价电子排布式为3s23p1;
Cu是29号元素,其原子核外有29个电子,其基态原子核外电子排布式为[Ar]3d104s1,Cu原子失去2个电子变为Cu2+,Cu2+的电子排布式为[Ar]3d9,
故答案为:1s22s22p5;3s23p1;[Ar]3d9;
(2)①N2中两个N原子之间只存在非极性键,为分子晶体;
②H2S中H原子和S原子之间只存在极性键,为分子晶体;
③KOH中钾离子和氢氧根离子之间存在离子键、H原子和O原子之间存在极性键,为含有极性键的离子化合物;
④MgCl2中镁离子和氯离子之间只存在离子键,为离子化合物;
⑤C2H4中C原子之间存在非极性键、C原子和H原子之间存在极性键,为分子晶体;
⑥Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性键,为离子化合物;
⑦NH4C1中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,为离子化合物;
⑧苯(C6H6)中C原子之间存在非极性键,C原子和H原子之间存在极性键,为分子晶体;
通过以上分析知,其中只含有非极性键的是①;只含有离子键的是④;既含有非极性键又含有极性键的是 ⑤⑧;含有非极性键的离子化合物是⑥,分子晶体中含有范德华力,所以上述物质存在范德华力的是 ①②⑤⑧,
故答案为:①;④;⑤⑧;⑥;①②⑤⑧;
(3)短周期元素中,X原子核外L层中只有两对成对电子,则X原子核外有8个电子,则为O元素;Y原子价电子排布为nsnnpn,s能级最多排列2个电子,则Y原子价电子排布式为2s22p2,则Y是C元素;Z原子最外层电子数比内层电子总数少4,则能层电子数为10,其最外层电子数是6,则Z是S元素,
CO2分子C原子只含2个σ键,则为直线形结构,SO2分子中价层电子对个数=2+
| 1 |
| 2 |
故答案为:直线形;V形.
点评:本题考查了化学键、分子构型的判断及原子核外电子排布式的书写,根据物质的构成微粒、价层电子对互斥理论等知识点来分析解答,知道核外电子排布式的书写方法,题目难度不大.

练习册系列答案
相关题目
在下列实验操作中错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计的水银球放置于蒸馏烧瓶的支管出口稍下处 |
| C、用容量瓶配制溶液时,加水超过了刻度线,没有采取补救措施,重新配制 |
| D、将5.85gNaCl溶于100mL水中,即配成1.0 mol/L NaCl溶液 |

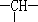 和一个-Cl,它可能的结构有
和一个-Cl,它可能的结构有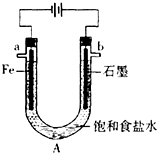 电解饱和食盐水装置的结构如图所示:
电解饱和食盐水装置的结构如图所示: