题目内容
18.乙烷的电子式为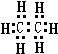 ,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.
,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.
分析 乙烷分子式为:C2H6,分子中碳原子与氢原子之间形成1对共用电子对,碳原子与碳原子之间形成1对共用电子对;
烷烃为饱和烃通式为:CnH(2n+2),据此计算分子式为CmH20的烷烃中m;
同温同压下,密度之比等于摩尔质量之比,据此写出CO2密度(同温同压)相同的烷烃分子式;
设烃分子式为CxHy,则1mol烃消耗氧气的物质的量为:x+$\frac{y}{4}$,该值越大耗氧量越多.
解答 解:因碳原子的最外层有4个电子,氢原子最外层1个电子,一个碳原子形成4对共用电子对,一个氢原子形成一对共用电子对,所以电子式为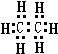 ;
;
据烷烃的通式CnH(2n+2),分子式为CmH20的烷烃中H为20,则2m+2=20,所以m=9;
同温同压下,密度之比等于摩尔质量之比,与CO2 密度(同温同压)相同的烷烃分,其相对分子质量应该和二氧化碳的相等,即为44,分子式为C3H8;
若上述四种烃各为1mol,1mol烃的耗氧量=x+$\frac{y}{4}$,分别是1molC2H6、C9H20、C3H8在足量O2中燃烧,消耗O2分别是:3.5mol、14mol、5mol,所以耗O2最多的是C9H20;
故答案为: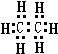 ;9;C3H8;C9H20.
;9;C3H8;C9H20.
点评 本题考查了烷烃电子式的书写、通式的应用、烃燃烧的耗氧规律,难度不大,注意对规律的理解与掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.判断下列反应的熵值增加的是( )
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
9.如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L.下列说法正确的是( )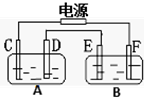

| A. | A池为电解池,B池为原电池 | B. | D、E两极都发生氧化反应 | ||
| C. | F极应为纯铜板材料 | D. | B池中E极质量增加12.8g |
6.表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)决定化学反应速率的因素是反应物本身的性质.
(2)实验1和2表明,固体反应物的表面积对反应速率有影响,而且,表面积越大,则反应速率越快;
(3)仅表明反应物浓度对反应速率产生影响的实验是1、3,而且,反应物的浓度越大,则反应速率越快;
(4)本实验中影响反应速率的其他因素还有温度,其实验序号是3、4(填实验序号);而且,温度越高,则反应速率越快;
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
(1)决定化学反应速率的因素是反应物本身的性质.
(2)实验1和2表明,固体反应物的表面积对反应速率有影响,而且,表面积越大,则反应速率越快;
(3)仅表明反应物浓度对反应速率产生影响的实验是1、3,而且,反应物的浓度越大,则反应速率越快;
(4)本实验中影响反应速率的其他因素还有温度,其实验序号是3、4(填实验序号);而且,温度越高,则反应速率越快;
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
3.下列有关化学用语表述正确的是( )
| A. | 醛基的结构简式-CHO | B. | 聚丙烯的结构简式 | ||
| C. | 乙醇的结构简式C2H6O | D. | 四氯化碳的电子式 |
7.下列有机化合物中,属于烃的衍生物的有( )
| A. | CH3CH3 | B. | CH2═CHCl | C. | CH3CH2OH | D. | CH3COOCH2CH3 |
8.下列物质中既含有离子键又含有共价键的是( )
| A. | KOH | B. | CO2 | C. | CaCl2 | D. | O2 |