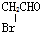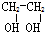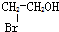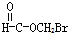题目内容
18.写出下列物质的电子式或者结构式| 化学式 | 电子式 | 结构式 |
| HCl | ||
| CO2 | ||
| CaCl2 | ||
| N2 | ||
| Na2S |
分析 氯化氢为共价化合物,氢原子和氯原子共用1对电子;
二氧化碳分子中碳原子与两个氧原子各共用2对电子,存在两个碳氧双键;
氯化钙为离子化合物,钙离子与两个氯离子通过离子键结合;
氮气分子中两个氮原子共用3对电子,存在氮氮双键;
硫化钠为离子化合物,两个钠离子与硫离子通过离子键结合.
解答 解:氯化氢为共价化合物,氯原子最外层7个电子,氢原子最外层1个电子,氯化氢中氢原子和氯原子共用1对电子,电子式为 ;结构式为:H-Cl;
;结构式为:H-Cl;
二氧化碳分子中存在两个碳氧双键,二氧化碳的电子式为: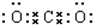 ,结构式为:O=C=O;
,结构式为:O=C=O;
氯化钙为离子化合物,钙离子与两个氯离子通过离子键结合,电子式为: ;结构式:无;
;结构式:无;
氮气分子中两个氮原子共用3对电子,电子式为: ;结构式为:N≡N;
;结构式为:N≡N;
硫化钠为离子化合物,两个钠离子与硫离子通过离子键结合,电子式: ,结构式:无;
,结构式:无;
故答案为:
| 化学式 | 电子式 | 结构式 |
| HCl |  | H-Cl |
| CO2 | 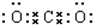 | O=C=O |
| CaCl2 |  | |
| N2 |  | N≡N |
| Na2S |  |
点评 本题考查了电子式、结构式的书写,题目难度中等,试题题量较大,充分考查了学生对书写知识的掌握情况,注意离子化合物不存在结构式,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇、苯和四氯化碳 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、己烯和己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用燃烧法鉴别甲烷、乙烯和乙炔 |
9.在溶液中有Fe3+存在时,则可与它同时大量存在的微粒是( )
| A. | OH- | B. | Fe | C. | H+ | D. | SCN- |
13.下列关于氧化还原反应的叙述中正确的是( )
| A. | 失去电子的反应为还原反应 | |
| B. | 含有氧元素的物质是氧化剂 | |
| C. | 氧化剂得到电子的数目和还原剂失去的电子的数目一定相等 | |
| D. | 氧化剂和还原剂不可能是同一种物质 |
3.根据表中信息,判断以下叙述正确的是部分短周期元素的原子半径及主要化合价( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的剧烈程度为L<Q | |
| C. | R最高价氧化物对应水化物是强酸 | |
| D. | L2+与R2-的核外电子数相等 |
10.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| B. | 加碘盐是食盐中加入碘单质 | |
| C. | 石英可用于生产光导纤维 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
7.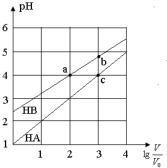 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c(B-)}{c(A-)}$减小 |
8.化学对环境保护有积极的意义,下列说法错误的是( )
| A. | 提高燃料的燃烧效率的意义在于节约能源、节省资源、减少污染 | |
| B. | CO、NO、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 按照绿色化学的原则,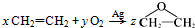 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 | |
| D. | 使用“无磷洗涤剂”,防止水体富营养化 |