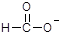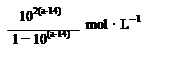题目内容
(1)H2S的燃烧热ΔH= -a kJ·mol-1,则H2S燃烧反应的热化学方程式为 。
(2)已知:高温下,在密闭容器中用H2还原WO2可得到金属钨。当温度过高时,WO2(s)会转变为WO2 (g)。请根据以下反应:
WO2 (s) + 2H2 (g) W (s) + 2H2O (g);ΔH= +66.0 kJ· mol-1
W (s) + 2H2O (g);ΔH= +66.0 kJ· mol-1
WO2 (g) + 2H2 W (s) + 2H2O (g);ΔH = -137.9 kJ· mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ· mol-1
计算出WO2 (s) WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
(3)工业上常利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,反应的化学方程式为:
CH4 + CO2 =" 2CO" + 2H2
已知CH4、H2和CO的燃烧热分别为890.3 kJ·mol-1、285.8 kJ·mol-1、283.0 kJ· mol-1,则生成1 m3(标准状况)CO所需热量为 ;
(2)已知:高温下,在密闭容器中用H2还原WO2可得到金属钨。当温度过高时,WO2(s)会转变为WO2 (g)。请根据以下反应:
WO2 (s) + 2H2 (g)
 W (s) + 2H2O (g);ΔH= +66.0 kJ· mol-1
W (s) + 2H2O (g);ΔH= +66.0 kJ· mol-1WO2 (g) + 2H2
 W (s) + 2H2O (g);ΔH = -137.9 kJ· mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ· mol-1计算出WO2 (s)
 WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。(3)工业上常利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,反应的化学方程式为:
CH4 + CO2 =" 2CO" + 2H2
已知CH4、H2和CO的燃烧热分别为890.3 kJ·mol-1、285.8 kJ·mol-1、283.0 kJ· mol-1,则生成1 m3(标准状况)CO所需热量为 ;
(1)2H2S(g)+3O2(g)="2" SO2(g)+2H2O(l), △H=-2akJ·mol-1(4分)
(2)△H="+203.9" kJ·mol-1(3分)
(3)5.52×103kJ(3分)
(2)△H="+203.9" kJ·mol-1(3分)
(3)5.52×103kJ(3分)
试题分析:(1)由燃烧热的定义可以写出H2S燃烧反应的热化学方程式;(2)观察所给三个热化学方程式知,用前一个已知热化学方程式减去后一个已知热化学方程式就可以得到WO2(s)?WO2(g),反应热也进行相应的运算;(3)根据CH4、H2、和CO的燃烧热可知,各物质燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ?mol -1,
即生成12molCO,需要吸热123.65KJ,故得到1立方米的CO吸热为
 =5.52×103KJ.,
=5.52×103KJ.,
练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目