题目内容
对水的电离平衡一定不产生影响的微粒是
A.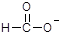 | B.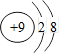 | C.1s22s22p6 | D.K+ |
D
试题分析:A、
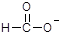 是甲酸(弱酸)根,会发生水解,错误;B、F-是弱酸根,会发生水解,错误;C、可能为F-等弱酸根,错误;D、K+对水的电离平衡一定不产生影响,正确。
是甲酸(弱酸)根,会发生水解,错误;B、F-是弱酸根,会发生水解,错误;C、可能为F-等弱酸根,错误;D、K+对水的电离平衡一定不产生影响,正确。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
题目内容
A.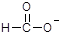 | B.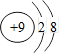 | C.1s22s22p6 | D.K+ |
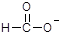 是甲酸(弱酸)根,会发生水解,错误;B、F-是弱酸根,会发生水解,错误;C、可能为F-等弱酸根,错误;D、K+对水的电离平衡一定不产生影响,正确。
是甲酸(弱酸)根,会发生水解,错误;B、F-是弱酸根,会发生水解,错误;C、可能为F-等弱酸根,错误;D、K+对水的电离平衡一定不产生影响,正确。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案