题目内容
19. 化学与人类社会可持续发展密切相关,能源、环境、工业生产以及日常生活等都离不开化学.
化学与人类社会可持续发展密切相关,能源、环境、工业生产以及日常生活等都离不开化学.(1)大量使用化石燃料,最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关.为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式CaO+SO2═CaSO3、2CaSO3+O2═CaSO4;国际上最新采用“饱和亚硫酸钠溶液吸收法”,请写出有关反应的化学方程式SO2+Na2SO3+H2O═2NaHSO3.
(2)氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.实验室可利用如图所示装置完成该反应,在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是NH4NO3(或:硝酸铵).
(3)三硅酸镁(Mg2Si2O8•nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.将0.184g三硅酸镁加到50mL 0.1mo1•L-1盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用 0.1mo1•L-1NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8•nH2O的n值为6.(注:Mg2Si3O8的摩尔质量为260g•mol-1)
分析 (1)煤中含有S,与氧气反应生成SO2,SO2与CaO反应生成CaSO3,进一步反应生成CaSO4,SO2与Na2SO3反应生成NaHSO3;
(2)氨气的催化氧化产物是一氧化氮和水,一氧化氮遇到空气迅速变为二氧化氮,二氧化到可以和水反应得到硝酸,硝酸可以和氨气反应生成硝酸铵;
(3)根据书写化学方程式的步骤:写配注等,正确书写方程式即可,根据化学方程式进行计算.
解答 解:(1)煤中含有S,与氧气反应生成SO2,反应方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,SO2与CaO反应生成CaSO3,反应方程式为CaO+SO2═CaSO3,进一步反应生成CaSO4,反应方程式为2CaSO3+O2═CaSO4,SO2与Na2SO3反应生成NaHSO3,反应方程式为SO2+Na2SO3+H2O═2NaHSO3,
故答案为:CaO+SO2═CaSO3、2CaSO3+O2═CaSO4;SO2+Na2SO3+H2O═2NaHSO3;
(2)氨气的催化氧化产物是一氧化氮和水,即4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2OO,在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,因为一氧化氮遇到空气迅速变为二氧化氮,二氧化氮可以和水反应得到硝酸,硝酸可以和氨气反应生成硝酸铵,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;NH4NO3(或硝酸铵);
(3)三硅酸镁中和胃酸(HCl)的化学方程式为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O,根据化学方程式,设0.184gMgSi3O8•nH2O的物质的量是x,得
Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O
1 4
x 0.050L×0.1mol/L-0.030L×0.1mol/L
$\frac{1}{x}$=$\frac{4}{0.050L×0.1mol/L-0.030L×0.1mol/L}$,解得x=0.0005mol,所以MgSi3O8•nH2O的摩尔质量是$\frac{0.184}{0.0005}$=368g/mol,Mg2Si3O8的摩尔质量为260g/mol,所以18n=108,即n=6.
故答案为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O;6.
点评 本题考查环境污染、复杂化学式的书写及计算等方面的知识,要求学生具有分析和解决问题的能力,难度大.

| A. | 电解质在水中发生了的电离,产生了能够自由移动的离子 | |
| B. | 酸性氧化物都是非金属元素形成的氧化物 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 只含一种元素的阳离子与另一种元素的阴离子所组成的物质一定是纯净物 |
| A. | 2A+3B=2C | B. | A十3B=2C | C. | 2A+B=3C | D. | A+B=C |
①Na2S和稀H2SO4 ②Na2SO3和盐酸 ③Na2S和盐酸 ④Na2SO3和稀H2SO4.
| A. | 只有① | B. | ①② | C. | ②③ | D. | ①④ |
| A. | 从1L1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1mol•L-1 | |
| B. | 配制0.5L 10 mol•L-1的盐酸,需要氯化氢气体112L(标准状况) | |
| C. | 0.5 L 2 mol•L-1的氯化钡溶液中,钡离子和氯离子总数为1.806×1024 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4 mol•L-1硫酸的浓度是不同的 |
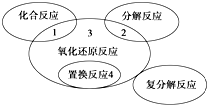 氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CO2 | D. | Zn+H2SO4═ZnSO4+H2↑ |
| A. | 用丁达尔效应区别溶液与胶体 | |
| B. | 橄榄油溶于水形成的液体,能发生丁达尔效应 | |
| C. | Al(OH)3胶体可以用来净水,是因为胶体有吸附性 | |
| D. | 胶体区别于其他分散系的本质是分散质粒子直径在10-9m~10-7m |
 向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点): 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.