题目内容
 某化学兴趣小组,模拟测定硫酸工业生产中SO2、N2和O2混合气体中SO2的体积分数,选用了下列简易实验装置:
某化学兴趣小组,模拟测定硫酸工业生产中SO2、N2和O2混合气体中SO2的体积分数,选用了下列简易实验装置:(1)若混合气的流向从左向右,则上述装置组装连接的顺序是:混合气→
(2)装置②中发生反应的离子方程式为
(3)下列试剂中,可以用来代替试管中碘的淀粉溶液的是
A.酸性KMnO4溶液B.NaOH溶液C.溴水D.氨水
(4)若碘溶液的浓度为0.05mol/L、体积为20mL,收集到的N2和O2的体积为297.6mL(已折算为标准状况下的体积),则SO2的体积分数为
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)原料气通过碘的淀粉溶液,碘能氧化H2SO3,生成H2SO4 ,吸收二氧化硫气体,通过装置ⅠⅢ排水量气测定仪器和氮气的体积;
(2)装置②中碘氧化二氧化硫生成硫酸和氢碘酸;装置②是吸收二氧化硫气体,碘的淀粉溶液是蓝色,当蓝色褪去,说明碘单质全部反应,应停止通气,否则造成误差;
(3)二氧化硫具有还原性,可以利用高锰酸钾溶液吸收,且现象明显,氢氧化钠虽能吸收二氧化硫其他单无明显现象,溴水可以吸收二氧化硫棕红色褪去,现象明显,氨水可以吸收二氧化硫,但实验现象无明显现象;
(4)依据碘单质氧化二氧化硫的化学方程式计算二氧化硫气体体积,得到原料气的总体积,计算二氧化硫的体积分数.
(2)装置②中碘氧化二氧化硫生成硫酸和氢碘酸;装置②是吸收二氧化硫气体,碘的淀粉溶液是蓝色,当蓝色褪去,说明碘单质全部反应,应停止通气,否则造成误差;
(3)二氧化硫具有还原性,可以利用高锰酸钾溶液吸收,且现象明显,氢氧化钠虽能吸收二氧化硫其他单无明显现象,溴水可以吸收二氧化硫棕红色褪去,现象明显,氨水可以吸收二氧化硫,但实验现象无明显现象;
(4)依据碘单质氧化二氧化硫的化学方程式计算二氧化硫气体体积,得到原料气的总体积,计算二氧化硫的体积分数.
解答:
解:(1)原料气通过碘的淀粉溶液,碘能氧化H2SO3,生成H2SO4 ,吸收二氧化硫气体,通过装置ⅠⅢ排水量气测定仪器和氮气的体积,连接装置接口顺序为:c→d→b→a→e;
故答案为:c→d→b→a→e;
(2)装置②中碘氧化二氧化硫生成硫酸和氢碘酸,发生反应的离子方程式为SO2+I2+2H2O=4H++SO42-+2I-;装置②是吸收二氧化硫气体,碘的淀粉溶液是蓝色,当蓝色褪去,说明碘单质全部反应,应停止通气,否则二氧化硫吸收不完全,造成误差偏低;
故答案为:SO2+I2+2H2O=4H++SO42-+2I-;蓝色恰好变成无色;偏低;
(3)二氧化硫具有还原性,可以利用高锰酸钾溶液吸收,且现象明显,氢氧化钠虽能吸收二氧化硫其他单无明显现象,溴水可以吸收二氧化硫棕红色褪去,现象明显,氨水可以吸收二氧化硫,但实验现象无明显现象;
故答案为:A、C;
(4)写出方程式I2+SO2+2H2O=2I-+SO42-+4H+
由条件知n(SO2)=n(I2)=0.05 mol/L×0.02 L=0.001 mol,即22.4 mL,
所以工业原料气总体积为 297.6 mL+22.4 mL=320 mL,
其中SO2的体积分数为
×100%=7%,故答案为:7%.
故答案为:c→d→b→a→e;
(2)装置②中碘氧化二氧化硫生成硫酸和氢碘酸,发生反应的离子方程式为SO2+I2+2H2O=4H++SO42-+2I-;装置②是吸收二氧化硫气体,碘的淀粉溶液是蓝色,当蓝色褪去,说明碘单质全部反应,应停止通气,否则二氧化硫吸收不完全,造成误差偏低;
故答案为:SO2+I2+2H2O=4H++SO42-+2I-;蓝色恰好变成无色;偏低;
(3)二氧化硫具有还原性,可以利用高锰酸钾溶液吸收,且现象明显,氢氧化钠虽能吸收二氧化硫其他单无明显现象,溴水可以吸收二氧化硫棕红色褪去,现象明显,氨水可以吸收二氧化硫,但实验现象无明显现象;
故答案为:A、C;
(4)写出方程式I2+SO2+2H2O=2I-+SO42-+4H+
由条件知n(SO2)=n(I2)=0.05 mol/L×0.02 L=0.001 mol,即22.4 mL,
所以工业原料气总体积为 297.6 mL+22.4 mL=320 mL,
其中SO2的体积分数为
| 22.4 |
| 320 |
点评:本题考查了二氧化硫性质分析,处理方法和计算应用,注意实验测定过程的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
常温时,将500mL pH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(假设溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生.下列说法错误的是( )
| A、若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a) g CuCO3 |
| B、?b<a<7 |
| C、阳极电极反应:2H2O-4e-═O2↑+4H+ |
| D、整个过程中是阳极产生氧气,阴极析出铜单质 |
下列各组混合物的分离或提纯方法不正确的是( )
| A、用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物 |
| B、用结晶法提纯NaCl和KNO3的混合物中的KNO3 |
| C、用蒸馏法分离乙醇和苯酚的混合物 |
| D、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |

 耗NaOH溶液的体积,分别计算乙酰水杨酸的质量分数.在上述测定过程中,为防止乙酰水杨酸在滴定过程中水解,应如何正确操作?并说明理由.
耗NaOH溶液的体积,分别计算乙酰水杨酸的质量分数.在上述测定过程中,为防止乙酰水杨酸在滴定过程中水解,应如何正确操作?并说明理由.
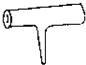 实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.
实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.