题目内容
3.在反应3S+6KOH═2K2S+K2SO3+3H2O中,被还原的硫与被氧化的硫质量比为2:1.当有0.3mol的S参加反应时,反应中转移的电子为0.4mol.分析 在反应3S+6KOH=2K2S+K2SO3+3H2O中,只有S元素的化合价发生变化,S→K2S,化合价降低,被还原,S→K2SO3,化合价升高,被氧化,根据氧化剂与还原剂得失电子数目相等计算.
解答 解:在反应3S+6KOH=2K2S+K2SO3+3H2O中,只有S元素的化合价发生变化,氧化剂和氧化剂都是S,
反应中S→K2S,S化合价降低,则S被还原,S为氧化剂,
S→K2SO3,S化合价升高,则S被氧化,S为还原剂,
由生成物可知,被还原与被氧化的S的物质的量之比为2:1,
则质量之比也为2:1,当参加反应的3mol的硫转移电子的物质的量为4mol,所以当有0.3mol的S参加反应时,反应中转移的电子为0.4mol,
故答案为:2:1;0.4.
点评 本题考查氧化还原反应的计算,题目难度不大,注意根据化合价的变化判断氧化产物和还原产物,可根据化学计量数直接判断出被还原的硫与被氧化的硫的质量比为.

练习册系列答案
相关题目
18.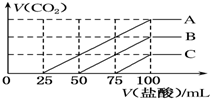 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2 mol•L-1 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分为NaOH和 Na2CO3,且物质的量相等 |
8. 乙酸丁酯沸点、溶解性如下表.
乙酸丁酯沸点、溶解性如下表.
某研究行学习小组设计实验制取乙酸丁酯的方案,其主要步骤如下:
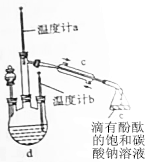
①在三颈瓶中d中加入按体积比1:4:4的比例配制浓硫酸、1-丁醇和乙酸的混合溶液.
②控制115-125℃均匀加热装有混合液的三颈瓶5-10min.
③待锥形瓶e收集到一定量的产物后停止加热,撤去锥形瓶e并用力振荡,然后静置待分层.
④分离出乙酸丁酯层,洗涤,干燥.
根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:先加入丁醇,然后边摇动试管边慢慢加入浓硫酸,再加乙酸;写出制取乙酸丁酯的化学方程式:CH3COOH+CH3CH2OH $→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填序号);
A.中和乙酸和1-丁醇
B.中和乙酸并吸收部分1-丁醇
C.乙酸丁酯在饱和碳酸钠溶液中的溶解度比在水中更小
D.加速酯的生成,提高其产率
(3)当温度计a(填写“a”或“b”)的温度读数达到126.3℃时,开始收集产品乙酸丁酯.
(4)指出步骤③所观察到的现象:在浅红色碳酸钠溶液层上方有无色液体出现,闻到香味,振荡后碳酸钠溶液层红色变浅;分离处乙酸丁酯后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去(填名称)碳酸钠、乙醇杂质;为了干燥乙酸丁酯可选用的干燥剂为(填序号)B.
A.五氧化二磷 B.无水硫酸钠
C.碱石灰 D.氢氧化钠固体.
 乙酸丁酯沸点、溶解性如下表.
乙酸丁酯沸点、溶解性如下表.| 物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 90%浓硫酸 |
| 沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
| 溶解性 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 微溶于水,溶于有机溶剂 | 与水混溶 |
①在三颈瓶中d中加入按体积比1:4:4的比例配制浓硫酸、1-丁醇和乙酸的混合溶液.
②控制115-125℃均匀加热装有混合液的三颈瓶5-10min.
③待锥形瓶e收集到一定量的产物后停止加热,撤去锥形瓶e并用力振荡,然后静置待分层.
④分离出乙酸丁酯层,洗涤,干燥.
根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:先加入丁醇,然后边摇动试管边慢慢加入浓硫酸,再加乙酸;写出制取乙酸丁酯的化学方程式:CH3COOH+CH3CH2OH $→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填序号);
A.中和乙酸和1-丁醇
B.中和乙酸并吸收部分1-丁醇
C.乙酸丁酯在饱和碳酸钠溶液中的溶解度比在水中更小
D.加速酯的生成,提高其产率
(3)当温度计a(填写“a”或“b”)的温度读数达到126.3℃时,开始收集产品乙酸丁酯.
(4)指出步骤③所观察到的现象:在浅红色碳酸钠溶液层上方有无色液体出现,闻到香味,振荡后碳酸钠溶液层红色变浅;分离处乙酸丁酯后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去(填名称)碳酸钠、乙醇杂质;为了干燥乙酸丁酯可选用的干燥剂为(填序号)B.
A.五氧化二磷 B.无水硫酸钠
C.碱石灰 D.氢氧化钠固体.
15.下列叙述中正确的是( )
| A. | 硝酸的摩尔质量是63 g | |
| B. | 1 mol CO的质量是28 g | |
| C. | 4 g氢气对应的摩尔质量是2 g氢气对应的摩尔质量的2倍 | |
| D. | 铁的摩尔质量在数值上等于铁原子的相对原子质量 |
12.在汽车排气管加装催化装置,可有效减少CO和NOx的排放,催化装置内发生反应为:NOx+CO$\stackrel{催化剂}{→}$N2+CO2下列关于此反应的说法中错误的是( )
| A. | 等物质的量N2和CO2中,共用电子对的个数比为3:4 | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 | |
| D. | 当x=2时,每生成1mol N2,转移电子数为4mol |

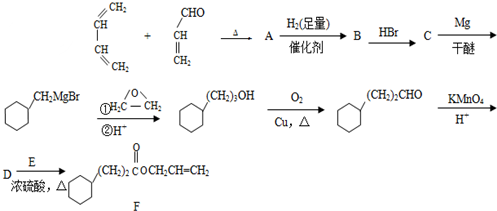

 ,A中所含官能团的名称是醛基、碳碳双键;
,A中所含官能团的名称是醛基、碳碳双键; ;
; ;
;