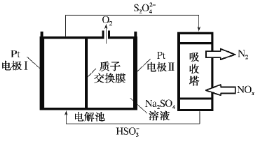
��Ŀ����
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ҫ�Ե⻯����ʽ���ڡ���һ��ѧ����С���ú���Ϊԭ����ȡ�����ⵥ�ʣ����ǽ��������ճɻң���ˮ����һ��ʱ�䣨�⻯�����ܽ���ˮ�У����õ�����������Һ��Ȼ������ʵ��������ȡ���ʵ⣺����֪��2I-+Cl2=2Cl-+I2��

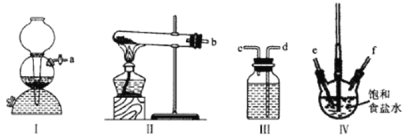
(1)ָ����ȡ��Ĺ������йص�ʵ��������ƣ���______���� _____��
(2)���̢��г�������Cl2��Ŀ����(�÷���ʽ����)_________________������Һ�е�I-ת����I2��
(3)�����������õ��л��Լ�������______________(ֻ��һ��)��
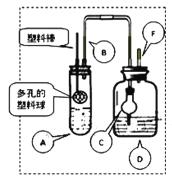
(4)�������̢ۿ��Էֽ�Ϊ���¼�����
A.��ʢ����Һ�ķ�Һ©����������̨����Ȧ�У�
B.��50mL��ˮ��15mL�л��ܼ������Һ©���У����Ǻò�������
C.�����Һ©���������ϿڵIJ������Ƿ�©Һ��
D.��ת©������������ʱ�����������������رջ������ѷ�Һ©��������
E.�������������ձ�������Һ��
F.�ӷ�Һ©���Ͽڵ����ϲ�Һ�壻
G.��©���ϿڵIJ�������ʹ���ϵİ�����©���Ͽڵ�С����
H.���á��ֲ㡣
���̢���ȷ���������˳���ǣ���������ĸ��_______��________��________��A��H��________��E��F��
���𰸡����� ��ȡ����Һ 2I-+Cl2=2Cl-+I2 ��(�����Ȼ�̼) C B D G
��������
�Ժ���Ϊԭ�ϻ�������ⵥ�ʣ������������������յõ������ң��������ҽ��ݵõ�����������Һ��Ȼ����ù��˵ķ�������������Һ���룬�õ����е⻯�ص���Һ����ˮ��Һ��ͨ������Cl2��������ӦΪ2I-+Cl2=2Cl-+I2�����еⵥ�ʵ���Һ�м�����ȡ�����Ȼ�̼��ȡ����õ��ⵥ�ʡ�
(1)�������ǽ���Һ�Ͳ����Թ������ķ����ǹ��ˣ��������Ǵӵ�ˮ�л�ȡ�ⵥ�ʲ�����ȡ����Һ�ķ�����
(2)���̢�ͨ��������Cl2���Խ�I-�������ɵ�I2����Ӧ����ʽΪ��2I-+Cl2=2Cl-+I2��
(3)����������I2���������л��ܼ�������ˮ���ܽ�Ȳ���ˮ���л��ܼ��������ݣ������е��ˮ��Һ���з��룬ʹ�õ��л�������DZ������Ȼ�̼������һ�֣�
(4)��ʵ�鲽���Ǽ�©����ҩƷ�������á����á�����������������������Һ�壬���������˳����CBDAHGEF��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����и�����������Һ�п��Դ������棬�Ҽ����ͨ���Լ�X������Ӧ�����ӷ���ʽ��ȷ����
ѡ�� | ������ | �Լ�X | ������Ӧ�����ӷ���ʽ |
A | K+��Na+�� | ����HCl | H2O+H++ |
B |
| ����H2S | Fe2++H2S=FeS��+2H+ |
C | ClO-��Na+��Ca2+�� | ����CO2 | CO2+Ca2++H2O+2ClO-=CaCO3��+2HClO |
D | I-��Cl-��Na+�� | ����ϡ���� | 6I-+2 |
A.AB.BC.CD.D