题目内容
将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经4min后,测得D的浓度为0.4mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol?(L?min)-1.
(1)A在4min末的浓度是 ,
(2)B在4min内的平均反应速率 .
(1)A在4min末的浓度是
(2)B在4min内的平均反应速率
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:(1)利用浓度变化量之比等于化学计量数之比计算A、B的浓度变化量,令A、B的起始浓度为amol/L,根据4min时A、B的浓度之比列方程,进而计算4min末A的浓度;
(2)根据v=
计算B的平均速率;
(2)根据v=
| △c |
| △t |
解答:
解:(1)4min时,测得D的浓度为0.4mol/L,浓度变化量之比等于化学计量数之比,故A的浓度变化量=
×0.4mol/L=0.6mol/L,B的浓度变化量=
×0.4mol/L=0.2mol/L,令A、B的起始浓度为amol/L,则:(a-0.6):(a-0.2)=3:5,解得a=1.2,故4min末时A的浓度=1.2mol/L-0.6mol/L=0.6mol/L,
故答案为:0.6mol/L;
(2)4min内B的浓度变化量=
×0.4mol/L=0.2mol/L,故v(B)=
=0.05mol/(L.min),
故答案为:0.05mol/(L?min).
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:0.6mol/L;
(2)4min内B的浓度变化量=
| 1 |
| 2 |
| 0.2mol/L |
| 4min |
故答案为:0.05mol/(L?min).
点评:本题考查化学反应速率的有关计算,比较基础,掌握速率规律是解题的关键.

练习册系列答案
相关题目
有x、y两种主族元素,它们的原子序数都小于18,它们的离子属于下列哪种情况,则x、y必属于同一周期的元素( )
| A、x、y的离子具有相同的电子层结构 |
| B、x-和y2-具有相同的电子层结构 |
| C、x+和y2-具有相同的电子层结构 |
| D、x-比y2-少一个电子层 |
在以下四种溶液中,各离子一定能大量共存的是( )
| A、滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、CO32- |
| B、含溶质为MgCl2的溶液:K+、NO3-、SO42-、Al3+ |
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、Na+、HCO3-、Br- |
| D、pH=1的溶液:Fe2+、Na+、I-、NO3- |
如图是产生和收集气体的实验装置,该装置最适合于( )
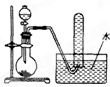

| A、用双氧水与二氧化锰反应制取O2 |
| B、用浓盐酸和MnO2反应制取Cl2 |
| C、用浓氨水和烧碱反应制取NH3 |
| D、用Na2SO3与硫酸反应制取SO2 |
它们的氯化物的化学式,最可能正确的是( )
| A、QCl2 |
| B、RCl3 |
| C、SCl2 |
| D、TCl |
 【化学--选修物质结构与性质】
【化学--选修物质结构与性质】 X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系.回答下列问题:
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系.回答下列问题: ;③
;③ ;④CH3COOC2H5;⑤CH3COOH ⑥C6H6⑦C6H5CH3;⑧C2H5Br物质中:
;④CH3COOC2H5;⑤CH3COOH ⑥C6H6⑦C6H5CH3;⑧C2H5Br物质中: