题目内容
(15分)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有 、 。
Ⅱ.测定中和热的实验装置如下图所示。
(3)大小烧杯之间填满碎泡沫塑料的作用是 ,从实验装置上看,图中缺少的一种玻璃仪器 。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | ℃ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是 。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
Ⅰ.(1)5.0(2分)
(2)250ml容量瓶(1分) 、胶头滴管。(1分)
Ⅱ.(3)保温、隔热、减少实验过程中的热量损失(2分);
环形玻璃搅拌棒或环形玻璃搅拌器。(1分)
(4)①3.4;(1分) ② —56.8kJ/mol(2分) ③A、C、D(2分)
(5)不相等(1分);相等(1分);偏小(1分)。
解析试题分析:Ⅰ.(1)若实验中大约要使用245 mL NaOH溶液,由于与该体积最接近的容量瓶是250mL,因此至少需要称量NaOH固体是(0.50 mol/L×0.25L)×40g/mol=5.0g;(2)配制物质的量浓度的溶液过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有250ml容量瓶、胶头滴管;Ⅱ.(3)大小烧杯之间填满碎泡沫塑料的作用是保温、隔热、减少实验过程中的热量损失;从实验装置上看,图中缺少的一种玻璃仪器环形玻璃搅拌棒或环形玻璃搅拌器;(4)①四组实验的温度差值是:3.4℃、6.1℃、3.3℃、3. 5℃,可见第二次实验数据偏差太大,应该舍去,平均温度是:(3.4℃+3.3℃+3. 5℃)÷3=3.4℃,②反应过程中放出的热量Q=c·m·Δt=4.18J/(mol·g·℃)×100g×3.4℃×10-3KJ/J=1.421KJ,n(H+)= 0.05L×0.25mol/L×2=0.025mol;n(OH-)="0.05L×0.55" mol/L="0.02750" mol>0.025mol,所以发生中和反应的物质的量应该以不足量的酸为标准,中和热△H=-Q÷n=-1.421KJ÷0.025mol=—56.8kJ/mol. ③A.实验装置保温、隔热效果差,使热量部分散失,导致中和热偏低,正确;B.量取NaOH溶液的体积时仰视读数,则NaOH的物质的量偏多,使热量产生的多,则中和热偏多,错误; C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,则在测量过程中热量会部分散失,导致中和热偏低,正确; D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,则在测量酸时就一部分反应放出,使热量部分散失,导致中和热偏低,正确。因此选项是A、C、D;(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,则n(H+)= 0.06L×0.25mol/L×2=0.003mol>0.02750 mol,所以放出的热量应该以酸为标准;由于反应的物质增多,所以与上述实验相比,所放出的热量就不相等;但是所求中和热由于是产生1mol的水时放出的热量,因此不会发生变化;若用50mL0.50mol/L醋酸代替H2SO4溶液进行上述实验,由于醋酸是弱酸,电离需要吸收热量,因此发生酸碱中和反应放出的热量就少,则测得反应前后温度的变化值会减小。
考点:考查中和热的测定的有关知识,包括数据处理、误差分析、不同物质的影响的知识。

 名校课堂系列答案
名校课堂系列答案下列有关物质的性质和该性质的应用均正确的是
| A.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气 |
| B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 |
| C.氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 |
D.钠的金属性比钾强,工业上用钠制取钾(Na+KCl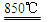 K↑+NaCl) K↑+NaCl) |
前18号元素中最外层电子数是次外层电子数一半的元素有
| A.1种 | B.2种 | C.3种 | D.4种 |
(14分)某实验小组用0.50mol/L氢氧化钠溶液和0.50mol/L硫酸溶液进行反应热的测定。
Ⅰ.配制0.50mol/L氢氧化钠溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体_________克。
(2)配制过程中,所需要的玻璃仪器有_____________________________________
Ⅱ.测定稀硫酸和稀氢氧化钠溶液反应的反应热实验装置如下: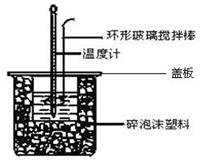
(3)如图装置中仪器环形玻璃搅拌棒作用是___________________________________;
(4)烧杯间填满碎泡沫塑料、大烧杯上加盖硬纸板的作用是__________________
(5)已知稀硫酸与稀氢氧化钠溶液发生中和反应生成1 mol水时,放出57.3 KJ热量。请写出硫酸与氢氧化钠发生中和反应的热化学方程式:__________________________________________,用0.2 mol 稀硫酸溶液与足量稀氢氧化钠溶液反应,能放出________kJ热量。
(6)在测定中和反应的反应热的实验中,下列叙述正确的是
| A.测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度 |
| B.中和反应的试验中,应快速将NaOH溶液一次倒入盛盐酸的小烧杯中 |
| C.可以用氢氧化钾代替氢氧化钠,浓硫酸代替稀硫酸 |
| D.在测定中和反应的反应热实验中,每完成一次反应热热测定,至少需要读三次温度 |
某温度下,反应SO2(g)+  O2(g)
O2(g) SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g) SO2(g) +
SO2(g) +  O2(g)的平衡常数K2的值为
O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.0.02 | D.0.001 |
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
| A.升高温度 | B.加入一种反应物 |
| C.对平衡体系增加压强 | D.使用催化剂 |
在CH3COOH溶液中存在如下平衡:CH3COOH H++CH3COO-。加入少量下列固体物质,能使平衡逆向移动的是
H++CH3COO-。加入少量下列固体物质,能使平衡逆向移动的是
| A.CH3COONa | B.NaCl | C.Na2CO3 | D.NaOH |
下列说法正确的是
| A.乙烯的结构简式可以表示为CH2CH2 | B.苯、乙醇和乙酸都能发生取代反应 |
| C.糖类、油脂、蛋白质均为高分子化合物 | D.乙酸不能与NaHCO3溶液反应生成CO2 |
