题目内容
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 1molCl2与足量Fe反应转移电子数一定为3NA | |
| C. | 1mol氨基(-NH2)中含电子数为10nA | |
| D. | 标况下,11.2LSO3所含的分子数目为0.5NA |
分析 A.Na2O和Na2O2的化学式中都由2个阳离子和1个阴离子构成;
B.1mol氯气与铁反应最多得到2mol电子;
C.氨基中含有9个电子,1mol氨基中含有9mol电子;
D.标况下三氧化硫不是气体.
解答 解:A.Na2O和Na2O2的化学式中都含有2个阳离子和1个阴离子,总共含有3个离子,则1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA,故A正确;
B.1molCl2与足量Fe反应生成氯化铁,最多得到2mol电子,所以转移电子数为2NA,故B错误;
C.1mol氨基(-NH2)中含有9mol电子,含有的电子数为9NA,故C错误;
D.标准状况下,三氧化硫的状态不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系为解答关键,注意明确标况下气体摩尔体积的使用条件,C为易错点,注意氨基中含有的电子数.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
20.下列说法不正确的是( )
| A. | 纯碱溶液清洗油污,加热可增强其去污能力 | |
| B. | 门窗玻璃、陶瓷餐具、玛瑙手镯、砖瓦所用材料为硅酸盐材料 | |
| C. | 聚丙烯酸钠是一种高吸水性树脂 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
17.下表中对应关系正确的是( )
| A | 甲基橙溶液呈黄色的溶液,一定能大量存在的离子 | Na+、Fe3+、Cl-、SO42- |
| B | 在久置的氯水中能大量共存的微粒 | K+、Al3+、NO3-、HCOOH |
| C | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全: | 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D | 1L0.1mol/LCuSO4溶液和足量的Ca充分反应 | 最终生成6.4gCu |
| A. | A | B. | B | C. | C | D. | D |
4.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
14.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T是地壳含量最多的金属元素,W所处的周期序数是其原子最外层电子数的一半.
(1)R的原子结构示意图是 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
| Q | R | ||
| T | W |
 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
1.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 符合分子式为C3H4Cl2的所有同分异构体数目为7种 | |
| C. | 丁烷、正戊烷、新戊烷、已烷的沸点依次升高 | |
| D. | 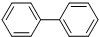 、 、 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 |
13.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2OH 1-丁醇 | ||
| C. |  对二甲苯 对二甲苯 | D. | 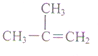 2-甲基-2-丙烯 2-甲基-2-丙烯 |


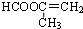 .
.