题目内容
7.设NA为阿伏伽德罗常数,下列叙述正确的是( )| A. | 28gC2H4所含共用电子对数目为4NA | |
| B. | 1 mol碳正离子(CH3+)所含的电子总数为8 NA | |
| C. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为(7/22.4)NA | |
| D. | 0.5mol 1,3-丁二烯分子中含有C=C双键数为0.5NA |
分析 A.依据n=$\frac{m}{M}$计算物质的量结合乙烯分子结构计算共用电子对数;
B.根据碳正离子发生了电子的转移进行判断;
C.标准状况下,庚烷不是气体,依据气体摩尔体积条件分析判断;
D.1,3-丁二烯分子中含有2个碳碳双键.
解答 解:A.28g乙烯物质的量为:$\frac{28g}{28g/mol}$=1mol,所含共用电子对数目为6NA,故A错误;
B.1mol碳正离子含有8mol电子,所含的电子总数为8NA,故B正确;
C.标况下,庚烷不是气体,无法计算庚烷的物质的量,故C错误;
D.1,3-丁二烯分子中含有2个碳碳双键,0.5mol 1,3-丁二烯分子中含有C=C双键数为NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数及其应用有机物物结构,题目难度不大,注意气体摩尔体积条件应用.掌握基础是解题关键.

练习册系列答案
相关题目
16.在一定温度下,向aL密闭容器中加入2molX气体和4molY气体,发生如下反应X(g)+2Y(g)?2Z(g),不能判断此反应达到平衡的是( )
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 单位时间内每消耗1molX就生成2molY | |
| D. | 混合气的相对分子质量不随时间变化 |
18.下列物质中属于非电解质,但其水溶液能导电的是( )
| A. | CH3COOH | B. | Cl2 | C. | NH4HCO3 | D. | SO2 |
2.已知:元素的最高价氧化物的水化物酸性越强其非金属性就越强,则下列判断正确的是( )
| A. | 亚硫酸的酸性大于碳酸,故硫的非金属性大于碳 | |
| B. | 碳酸的酸性大于次氯酸,故碳的非金属性大于氯 | |
| C. | 硝酸的酸性大于硅酸,故氮的非金属性大于硅 | |
| D. | 氢氟酸的酸性大于氢氯酸,故氟的非金属性大于氯 |
19.下列有机物的名称肯定错误的是( )
| A. | 1,2-二溴丁烷 | B. | 2-甲基-3-丁烯 | ||
| C. | 3-乙基戊烷 | D. | 1,1,2,2--四溴乙烷 |
17.下列有关物质性质的说法错误的是( )
| A. | 酸性:H2SO4>HClO4 | B. | 原子半径:Na>Mg | ||
| C. | 热稳定性:HCl>HI | D. | 还原性:S2->Cl- |
 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
 .
.
 ,C的化学名称是2,3-二甲基-1,3-丁二烯,反应⑥的化学方程式为
,C的化学名称是2,3-二甲基-1,3-丁二烯,反应⑥的化学方程式为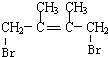 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr,④的反应类型是加成反应.
+2NaBr,④的反应类型是加成反应.