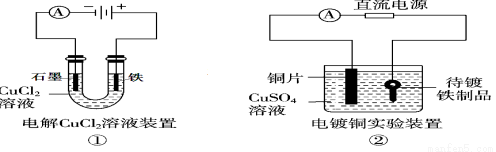
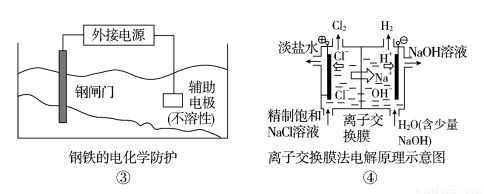
题目内容
关于化学反应与能量的有关说法正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.化学键断裂时吸收能量,化学键形成时放出能量
D.化学反应中的能量变化都表现为热量的变化
在相同温度和压强下,对反应CO2(g)+H2(g)  CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内 各组
各组 分的物质的量见下表:
分的物质的量见下表:
CO2 | H2 | CO | H2O(g) | |
甲 | a mol | a mol | 0 mol | 0 mol |
乙 | 2a mol | a mol | 0 mol | 0 mol |
丙 | 0 mol | 0 mol | a mol | a mol |
丁 | a mol | 0 mol | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是 ( )
A.乙>丁>甲>丙 B.乙=丁>丙=甲
C.丁>乙>丙=甲 D.丁>丙>乙>甲
已知
Fe(s)+CO2(g) FeO(s)+CO(g) K1 ①
FeO(s)+CO(g) K1 ①
Fe(s)+H2O(g) FeO(s)+H2(g) K2 ②
FeO(s)+H2(g) K2 ②
H2(g)+CO2(g) H2O(g)+CO(g) K3 ③
H2O(g)+CO(g) K3 ③
又已知不同温度下,K1、K2值如右表:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)判断反应③达到化学平衡状态的依据是____________。
a.混合气体的平均摩尔质量不变
b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆
d.断裂2 mol H—O键的同时生成1 mol H—H键
(2)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,2分钟后建立平衡,则CO2转化率为________,用CO表示的速率为________________。
(3)下列图象不符合反应②的是___________(填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。

(4)900 ℃进行反应③,其平衡常数K3为____________(求具体数值),焓变ΔH__________0(填“>”“=”或“<”),理由是 。



 1.8 kJ•mol﹣1
1.8 kJ•mol﹣1 2NH3(g) △H<0,下列研究目的和图示相符的是()
2NH3(g) △H<0,下列研究目的和图示相符的是()
 CO(g)+H2(g)△H>O,反应速率为v1;2SO2(g)+O2(g
CO(g)+H2(g)△H>O,反应速率为v1;2SO2(g)+O2(g