题目内容
13.如图是元素周期表的一部分,下列说法中,正确的是( )
| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:⑤>③ | ||
| C. | 元素的最高正化合价:④=② | D. | 最高价氧化物对应水化物酸性:⑤>④ |
分析 对照元素周期表便可确定①、②、③、④、⑤分别是N、O、F、S、Cl,
A、根据元素原子序数确定元素的位置;
B、同主族元素的原子,从上到下气态氢化物的稳定性逐渐减弱;
C、S的最高正化合价为+6,O没有正化合价;
D、同周期元素的原子,非金属性越强,则最高价氧化物对应水化物酸性越强.
解答 解:对照元素周期表便可确定①、②、③、④、⑤分别是N、O、F、S、Cl.
A、元素①是N,位于第二周期第ⅤA族,故A错误;
B、Cl的非金属性比F弱,因此HCl的热稳定性比HF弱,故B错误;
C、S的最高正化合价为+6,O没有正化合价,故C错误;
D、Cl的非金属性比S强,HClO4的酸性大于H2SO4,故D正确.
故选D.
点评 本题是一道关于元素周期表和元素周期律的综合应用题,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
14.我国最新报道的高温超导体中,铊(Ti)是组成的成分之一,已知铊与铝是同族元素,关于铊的性质的判断可能错误的是( )
| A. | 是银白色、质软的金属 | |
| B. | 阳离子氧化性比铝离子强 | |
| C. | 加热蒸干TiCl3溶液可得到无水TiCl3 | |
| D. | 与稀硝酸作用生成硝酸盐 |
1.下列有关实验的叙述,正确的是( )
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
8.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ne(填具体元素符号);非金属性最强的元素是F(填具体元素符号),原子结构示意图为 .元素⑩名称为溴.
.元素⑩名称为溴.
(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)在这些元素中,最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是②(填编号)
(5)⑥⑦⑧⑨四种元素对应的简单离子中,离子半径最小的是Al3+(填离子符号)
(6)⑧和⑨都是重要的非金属元素.下列叙述中,能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧
b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质
d.⑨的氢化物的酸性比⑧的氢化物的酸性强.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
 .元素⑩名称为溴.
.元素⑩名称为溴.(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)在这些元素中,最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是②(填编号)
(5)⑥⑦⑧⑨四种元素对应的简单离子中,离子半径最小的是Al3+(填离子符号)
(6)⑧和⑨都是重要的非金属元素.下列叙述中,能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧
b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质
d.⑨的氢化物的酸性比⑧的氢化物的酸性强.
5.汽车在剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,下列关于该反应的说法正确的是( )
| A. | 22.4LN2中σ键与π键个数比为1:2 | |
| B. | 反应物和生成物中只有氮气属于非电解质 | |
| C. | 该反应每转移1mol电子,有0.2molKNO3被氧化 | |
| D. | NaN3是只含离子键的离子化合物 |
2.下列关于硅原子的核外电子排布表示式(或排布图)中,错误的是( )
| A. | 1s22s22p63s23p2 | B. | [Ne]3s23p2 | ||
| C. | 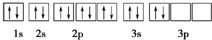 | D. |  |
3.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+=H2O | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |