题目内容
6.在不同温度下,将2mol X、2mol Y分别充入到不同体积的容器中,发生反应:X(g)+Y (g)?mZ(g)△H,所得Z的平衡浓度如表所示,下列说法正确的是( )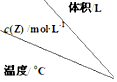 | 1 | 2 | 3 |
| 200 | $\frac{8}{3}$ | $\frac{4}{3}$ | $\frac{8}{9}$ |
| 300 | 2.4 | 1.2 | 0.8 |
| 400 | 2.0 | 1.0 | $\frac{2}{3}$ |
| A. | m=2,△H>0 | |
| B. | 300℃时,该反应平衡常数 K=9 | |
| C. | 在3L容器中进行反应,达到平衡的时间:400℃>200℃ | |
| D. | 200℃,2L容器中反应达平衡后,再充入2 mol Z,平衡时 Z 的体积分数增大 |
分析 根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Z的浓度降低的倍数等于2,所以可确定反应前后体积相等,得m=2;当体积相同时,温度升高,Z的浓度减小,即平衡逆向移动,所以此反应的逆向为吸热反应,由此分析解答.
解答 解:在温度相同的条件下,当体积扩大到原来的两倍时,Z的浓度降低的倍数等于2,所以可确定反应前后体积相等,得m=2;当体积相同时,温度升高,Z的浓度减小,即平衡逆向移动,所以此反应的逆向为吸热反应,
A、逆向为吸热反应,正反应为放热反应,所以m=2,△H<0,故A错误;
B、平衡常数是温度的函数,体积为1L容器中,
X(g)+Y (g)?2Z(g)
初起:2mol/L 2mol/L 0
变化:1.2mol/L 1.2mol/L 2.4mol/L
平衡:0.8mol/L 0.8mol/L 2.4mol/L
所以K=$\frac{2.4×2.4}{0.8×0.8}$=9,所以300℃时,该反应平衡常数 K=9,故B正确;
C、温度越高反应速率越快,达平衡的时间越短,所以达到平衡的时间:400℃<200℃,故C错误;
D、200℃,2L容器中反应达平衡后,再充入2 mol Z,相当于增大压强,平衡不移动,平衡时 Z 的体积分数不变,故D错误;
故选B.
点评 本题主要通过控制变量讨论化学平衡移动问题,对于学生的基本功要求较高,题目难度中等.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
14.一定温度下,存在溶解平衡关系:BaSO4(固体)?Ba2++SO42-.向该悬浊液中加入饱和Na2CO3溶液,下列叙述正确的是( )
已知Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=8.1×10-9.
已知Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=8.1×10-9.
| A. | BaSO4一定能转化为BaCO3 | B. | BaSO4一定不能转化为BaCO3 | ||
| C. | BaSO4有可能转化为BaCO3 | D. | 无法通过实验来验证是否发生转化 |
11.若 A+酸=盐+水,则A不可能属于( )
| A. | 氧化物 | B. | 胶体 | C. | 碱 | D. | 单质 |
18.用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA | |
| B. | 通常状况下,8g O2和O3 的混合气体含有的分子数是0.5NA | |
| C. | 常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA | |
| D. | 标准状况下,11.2L H2在氧气中完全燃烧后得到的产物的分子数为0.5NA |
16.下列属于酸性氧化物的是( )
| A. | 一氧化碳 | B. | 过氧化钠 | C. | 氧化铝 | D. | 二氧化硫 |
 .
.
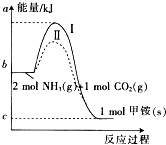 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如图所示.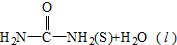 △H=+dkJ•mol-1,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为CO2(g)+2NH3(g)=
△H=+dkJ•mol-1,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为CO2(g)+2NH3(g)=