题目内容
20.环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).NO3-+10Al+18H2O→10Al(OH)3+3N2↑+6OH-
该反应过程中,被氧化与被还原的元素的物质的量之比为5:3.
分析 反应中NO3-→N2,N元素化合价由+5价降低为0价,共降低10价,Al→Al(OH)3,Al元素化合价由0价升高为+3价,共升高3价,根据电荷守恒可知OH-是生成物,由H元素守恒可知H2O是反应物,化合价升降最小公倍数为30,故N2系数为3,Al系数为10,根据电荷守恒、元素守恒配平其它物质的系数;根据方程式判断被氧化与被还原的元素的物质的量之比.
解答 解:反应中NO3-→N2,N元素化合价由+5价降低为0价,共降低10价,Al→Al(OH)3,Al元素化合价由0价升高为+3价,共升高3价,根据电荷守恒可知OH-是生成物,由H元素守恒可知H2O是反应物,化合价升降最小公倍数为30,故N2系数为3,Al系数为10,根据N元素守恒可知NO3-系数为6,根据Al元素守恒可知Al(OH)3系数为10,电荷守恒可知OH-系数为6,根据H元素守恒可知H2O系数为,配平后离子方程式为6NO3-+10Al+18H2O=10Al(OH)3+3N2+6OH-.由方程式可知被氧化与被还原的元素的物质的量之比10:6=5:3.
故答案为:10Al、18H2O=10Al(OH)3、3N2↑、6OH-;5:3.
点评 本题主要考查氧化还原反应配平及其概念的判断,难度中等,抓住氧化还原反应的特征及其得失电子守恒进行配平,难度不大.

练习册系列答案
相关题目
19.已知下表为25℃时某些弱酸的电离平衡常数.依据所给信息判断,下列说法正确的是( )
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)═c(OH-)-c(H+) | |
| C. | 25℃时,0.10mol•L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)═c(CO32-)+c (HCO3-)+c(H2CO3) | |
| D. | 向0.1mol•L-1CH3COONa溶液中加入少量水,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)•c(O{H}^{-})}$ 增大 |
20.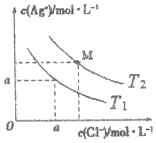 已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )
已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )
 已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )
已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )| A. | T1>T2 | |
| B. | a=4.0×10-5 | |
| C. | M点溶液温度变为T1时,溶液中Cl-的浓度不变 | |
| D. | T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L |
8. 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )| A. | 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应 | |
| B. | 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸 | |
| C. | 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲 | |
| D. | 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
15.对于实验I〜IV的描述正确的是( )


| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡. | |
| B. | 实验II:充分振荡后静置,下层溶液为橙红色,上层无色 | |
| C. | 实验III:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置IV:逐滴加入NaOH溶液时,可以看到白色沉淀,转而变成灰绿色,最后是红褐色 |
12.常见无机物A、B、C、D存在如图转化关系(部分产物已略去),下列说法错误的是( )

| A. | 若B、D是空气的主要成分,则A可能用做制冷剂 | |
| B. | 若A、B、C的水溶液均显碱性,焰色反应均为黄色,则C可能用做胃酸中和剂 | |
| C. | 若D为生产生活中用量最大、用途最广泛的金属单质,则B可能为Fe( NO3)2 | |
| D. | 若B具有两性,则D可能为NaOH溶液或盐酸 |
9.下列物质中,发生消去反应生成的烯烃只有一种的是( )
| A. | 2-丁醇 | B. | 2-戊醇 | C. | 2-甲基-2-丙醇 | D. | 2-甲基-2-丁醇 |