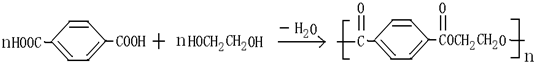题目内容
12.某气态烷烃与丙炔的混合气体22.4L ( 标准状况 ),完全燃烧后生成121g CO2和40.5g H2O,则原混合气体中烷烃的分子式为( )| A. | C3H8 | B. | CH4 | C. | C2H6 | D. | C4H10 |
分析 混合气体22.4L,物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,n(CO2)=$\frac{121g}{44g/mol}$=2.75g,n(H2O)=$\frac{40.5g}{18g/mol}$=2.25mol,根据混合物的平均分子式确定烷烃的分子式.
解答 解:混合气体22.4L,物质的量为物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,n(CO2)=$\frac{121g}{44g/mol}$=2.75g,n(H2O)=$\frac{40.5g}{18g/mol}$=2.25mol,
该混合烃中平均C原子数为:$\frac{2.75mol}{1mol}$=2.75,平均H原子数为:$\frac{2.25mol×2}{1mol}$=4.5,
则该混合烃的平均分子式为:C2.75H4.5,
已知一种气体为丙炔,分子式为C3H4,则该烷烃分子中含有的C原子数小于3,含有的H原子数大于4,
满足条件的烷烃只有C2H6,
故选C.
点评 本题考查有关混合物反应的计算,题目难度中等,根据题干信息计算出平均分子式为解答关键,注意讨论法、平均分子式法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2. 科学家研制出多种新型杀虫剂代替DDT,化合物M是其中的一种.下列关于M的说法错误的是( )
科学家研制出多种新型杀虫剂代替DDT,化合物M是其中的一种.下列关于M的说法错误的是( )
 科学家研制出多种新型杀虫剂代替DDT,化合物M是其中的一种.下列关于M的说法错误的是( )
科学家研制出多种新型杀虫剂代替DDT,化合物M是其中的一种.下列关于M的说法错误的是( )| A. | M的分子式为C15H22O3 | |
| B. | 与FeCl3溶液发生反应后溶液不显紫色 | |
| C. | M可以发生银镜反应 | |
| D. | 1molM最多与1molH2完全加成 |
3.下列关乙醇的性质中,不正确的是( )
| A. | 乙醇可以与钠作用生成氢气 | B. | 乙醇可以被氧化为乙醛 | ||
| C. | 乙醇与乙烷互为同分异构体 | D. | 乙醇有挥发性 |
20.元素周期律产生的根本原因就是随着元素原子序数的递增( )
| A. | 元素的相对原子质量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 原子半径呈周期性变化 | D. | 元素主要化合价呈周期性变化 |
7.某有机物结构简式为: 它可能具有的性质是( )
它可能具有的性质是( )
①能使KMnO4酸性溶液褪色 ②能与NaOH溶液反应③能发生聚合反应 ④最多能与2molBr2发生反应.
 它可能具有的性质是( )
它可能具有的性质是( )①能使KMnO4酸性溶液褪色 ②能与NaOH溶液反应③能发生聚合反应 ④最多能与2molBr2发生反应.
| A. | ①②④ | B. | ②③④ | C. | ①②③ | D. | ①②③④ |
17.无水氯化镁是制备某种催化剂的中间体.某研究性学习小组设计实验方案进行制取无水氯化镁等实验.请填写下列空白.
[实验一]利用如图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2•6H2O晶体制取无水氯化镁(无水氯化镁易吸水).烧瓶中发生的反应为:NaCl+H2SO4(浓)═NaHSO4+HCl↑
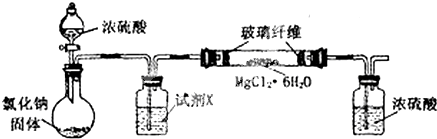
(1)试剂X是浓硫酸.
(2)该实验装置存在一个缺陷是没有尾气处理装置.
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;②加入足量硝酸银溶液,充分反应后,过滤;③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g.
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量偏高(填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2•nH2O中n的值为$\frac{1}{2}$.
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂.为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如表对比实验:
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
(5)表中ω=74.45.
(6)从实验1、2可以得出的结论是氯化镁固体含水量越高,催化剂催化效果越差.
(7)设计实验2、3的目的是探究粉碎方式对催化剂催化效果的影响.
[实验一]利用如图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2•6H2O晶体制取无水氯化镁(无水氯化镁易吸水).烧瓶中发生的反应为:NaCl+H2SO4(浓)═NaHSO4+HCl↑

(1)试剂X是浓硫酸.
(2)该实验装置存在一个缺陷是没有尾气处理装置.
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;②加入足量硝酸银溶液,充分反应后,过滤;③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g.
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量偏高(填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2•nH2O中n的值为$\frac{1}{2}$.
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂.为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如表对比实验:
| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式 | 催化效果/g•g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 | 6.5×104 |
(5)表中ω=74.45.
(6)从实验1、2可以得出的结论是氯化镁固体含水量越高,催化剂催化效果越差.
(7)设计实验2、3的目的是探究粉碎方式对催化剂催化效果的影响.
4.石油炼制过程中,既能提高汽油产量又能提高汽油质量的方法是( )
| A. | 蒸馏 | B. | 分馏 | C. | 裂解 | D. | 裂化 |