题目内容
锌铜原电池产生电流时,阴离子( )
| A、移向Zn极,阳离子移向Cu极 |
| B、移向Cu极,阳离子移向Zn极 |
| C、和阳离子都移向Zn极 |
| D、和阳离子都移向Cu极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动,据此分析解答.
解答:
解:Cu-Zn原电池中,Zn易失电子作负极、Cu作正极,电子从负极Zn沿导线流向正极,所以正极上聚集大量电子,根据异性相吸知,电解质溶液中阳离子向正极移动、阴离子向负极移动,故选A.
点评:本题考查原电池原理,侧重考查学生对离子移动方向分析,明确正负极附近存在微粒所带电性即可解答,为易错题.

练习册系列答案
相关题目
已知c(NH4Cl)<0.1mol?L-1时,溶液的pH>5.1,现用0.1mol?L-1盐酸滴定10mL 0.05mol?L-1氨水,用甲基橙作指示剂,达到终点时所用盐酸的量应是( )
| A、10 mL |
| B、5 mL |
| C、大于5 mL |
| D、小于5 mL |
下列关于金属腐蚀的说法中不正确的是( )
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C、纯的金属一般难以发生电化学腐蚀 |
| D、镀锌铁当镀层破损后,镀层则对铁失去了保护作用 |
如图装置分别通电一段时间后,溶液的质量增加的是( )
A、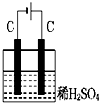 |
B、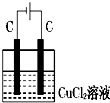 |
C、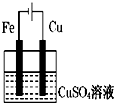 |
D、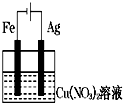 |
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C、CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子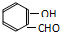 ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( 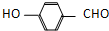 )之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
)之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
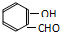 ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(  )之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
)之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )| A、前者>后者 | B、前者<后者 |
| C、前者=后者 | D、无法估计 |
能正确表示下列反应的离子方程式是( )
| A、Ba(OH)2与稀H2SO4反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、饱和碳酸钠溶液中通入足量CO2 CO32-+H2O+CO2═2HCO3- |
| C、C12与NaOH溶液反应 Cl2+2OH-═C1-+C1O-+H2O |
| D、把金属铁放入稀硫酸中 2Fe+6H+═2Fe3++3H2↑ |