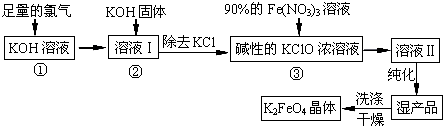
题目内容
5.25℃、101kPa时,甲烷、乙烷和乙烯组成的混合气体32mL,与过量氧气混合并完全燃烧,恢复到原来的温度和压强,气体总体积缩小72mL,原混合气体中乙烷的体积分数为( )| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
分析 根据有机物燃烧的化学反应方程式,分析反应前后气体体积的变化,利用气体体积缩小了72mL及混合气体的体积来列等式计算出乙烯的体积,最后计算乙烯的体积分数.
解答 解:CH4+2O2=CO2+2H2O?△V
1 2 1 2
C2H6+$\frac{7}{2}$O2=2CO2+3H2O△V
1 $\frac{7}{2}$ 2 2.5
C2H4+3O2=2CO2+H2O?△V
1 3 2 2
则CH4和C2H4反应后体积缩小的量是相同的,故可将两者看成是一种物质即可,
设CH4和C2H4一共为xmL,C2H6为ymL,
则:x+y=32、2x+2.5y=72,
解得:x=16,y=16,
则原混合烃中乙烷的体积为:$\frac{16mL}{32mL}$×100%=50%,
故选C.
点评 本题考查混合物的计算、根据方程式进行的计算,为高频考点,题目难度中等,侧重于学生的分析能力和计算能力的考查,注意差量法运用简化计算过程.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
15.为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
(1)设计实验2和实验3的目的是研究H2O2的浓度对化学反应速率的影响;
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号);
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1KI溶液②0.1mol•L-1 FeCl3溶液③0.1mol•L-1 FeCl2溶液
④0.1mol•L-1盐酸⑤0.1mol•L-1KSCN溶液⑥CCl4
实验步骤:
(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),溶液出现血红色现象,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示:
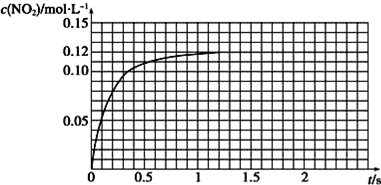
(1)反应容器中最后剩余的物质有NO2、N2O4,其中N2O4的物质的量为0.004molmol;
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.(选填“变大”,“变小”或“不变”)
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号);
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1KI溶液②0.1mol•L-1 FeCl3溶液③0.1mol•L-1 FeCl2溶液
④0.1mol•L-1盐酸⑤0.1mol•L-1KSCN溶液⑥CCl4
实验步骤:
(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),溶液出现血红色现象,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示:

(1)反应容器中最后剩余的物质有NO2、N2O4,其中N2O4的物质的量为0.004molmol;
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.(选填“变大”,“变小”或“不变”)
16.含一个苯环(不再含有其他环状结构)的化合物的分子式为 C11H16,分子中还有 2 个-CH3,2 个-CH2-和一个-CH-,则该分子符合上述条件的可能结构有( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
13.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位同学分别设计了如下四个实验,你认为结论正确的是( )
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,可看到有氢气生成 | |
| B. | 将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度NaOH溶液反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 大理石和盐酸反应制取CO2,增加大理石的用量可加快反应速率 |
20.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,22.4L O2所含的原子数为2NA | |
| B. | 标准状况下,22.4L H2所含的分子数为NA | |
| C. | 标准状况下,22.4L H2O所含的分子数为NA | |
| D. | 56g铁粉与盐酸完全反应时转移电子数为3NA |
10.NA代表阿伏伽德罗常数,下列关于电子转移的说法正确的是( )
| A. | 5.6g Fe参与反应转移的电子数一定为0.2NA | |
| B. | 2.3g Na参与反应转移的电子数一定为0.1NA | |
| C. | 标况下,2.24L Cl2参与反应转移的电子数一定为0.2NA | |
| D. | 标况下,2.24L O2参与反应转移的电子数一定为0.4NA |
4.下列叙述正确的是( )
| A. | H2O2的相对分子质量为34g | |
| B. | CH4的摩尔质量为16 g | |
| C. | 1 mol SO42--的质量为96g | |
| D. | 标准状况下1 mol H2O 的体积是22.4 L |
5.在1~18号元素中,最外层上的电子数与电子层数相同,该元素可能有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |