题目内容
2.在Al2(SO4)3溶液中滴加少量NaOH溶液,化学方程式为Al2(SO4)3+6NaOH═2Al(OH)3↓+3Na2SO4;继续加入过量的NaOH溶液,离子方程式为Al(OH)3+OH-═AlO2-+2H2O;在FeSO4溶液中滴加少量NaOH溶液,现象为生成白色沉淀,后迅速变成灰绿色,最后变成红褐色..分析 硫酸铝与少量氢氧化钠反应生成硫酸钠和氢氧化铝沉淀;
氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
硫酸亚铁与氢氧化钠溶液反应生成氢氧化亚铁沉淀,氢氧化亚铁不稳定,与空气氧气、水反应生成氢氧化铁,据此解答.
解答 解:硫酸铝与少量氢氧化钠反应生成硫酸钠和氢氧化铝沉淀,化学方程式:Al2(SO4)3+6NaOH═2Al(OH)3↓+3Na2SO4;
继续加入过量的NaOH溶液,氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式:Al(OH)3+OH-═AlO2-+2H2O;
硫酸亚铁与氢氧化钠溶液反应生成氢氧化亚铁沉淀,氢氧化亚铁为白色沉淀,氢氧化亚铁不稳定,与空气氧气、水反应生成氢氧化铁,氢氧化铁为红褐色沉淀,所以看到现象为:先生成白色沉淀,后迅速变成灰绿色,最后变成红褐色;
故答案为:Al2(SO4)3+6NaOH═2Al(OH)3↓+3Na2SO4;
Al(OH)3+OH-═AlO2-+2H2O;
生成白色沉淀,后迅速变成灰绿色,最后变成红褐色;
点评 本题考查了化学方程式、离子方程式的书写,侧重考查铝及其化合物性质,明确氢氧化铝为两性氢氧化物,与氢氧化钠反应生成偏铝酸盐是解题关键,注意二价铁离子与三价铁离子之间转化,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 互称为同分异构体的物质不可能具有相同的通式 | |
| B. | 具有相同官能团的有机物不一定是同系物 | |
| C. | 糖类、油脂、蛋白质都是仅含C、H、O元素的有机物 | |
| D. | 燃烧产物是CO2、H2O的有机物一定烃类 |
13.某学生进行了“浓度影响化学反应速率”的探究实验,原始数据记录如下:
(1)比较三组数据,初步得出的结论是:当其他条件不变时,H2SO4(填化学式)的浓度增加,反应速率加快(填“加快”、“减慢”或“不变”);
(2)写出该反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,该反应中还原剂是Zn,从反应分类角度来看,该反应既属于氧化还原反应,又属于置换反应(填四大基本反应类型之一).
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 12g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
(2)写出该反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,该反应中还原剂是Zn,从反应分类角度来看,该反应既属于氧化还原反应,又属于置换反应(填四大基本反应类型之一).
17.充分燃烧1mol气态烃R,得到标准状况下44.8LCO2和54gH2O,则R是( )
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C4H6 |
14.化合物G(结构如图)是合成抗癌药氨柔比星的中间体.下列说法正确的是( )
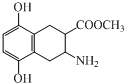

| A. | 该有机物的分子式为C12H14NO4 | |
| B. | 该有机物既可与盐酸反应,又可与NaOH溶液反应 | |
| C. | 该有机物中含有2个手性碳原子 | |
| D. | 1mol该有机物最多只能与1molBr2发生取代反应 |
2.实现下列变化时,需要克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和醋酸钠的熔化 | ||
| C. | 液溴和液汞的汽化 | D. | 氨的气化和水的电离 |

 ;
; ,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.
,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.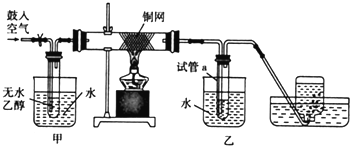
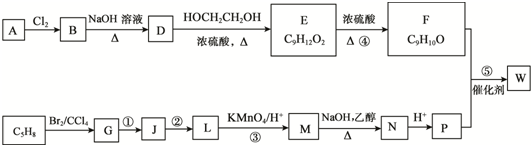
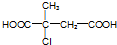 .
. (R1~R4表示烃基)
(R1~R4表示烃基) .
.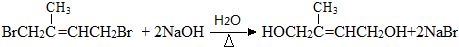 .
. .
. .
.