题目内容
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.请按要求回答以下问题:
(1)如图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 ,E与D按原子个数比1﹕1形成的化合物的电子式为 .
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能: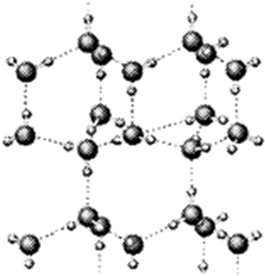
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为 ,
③已知加热下可发生如下转化:F(s)+D2(g)
FD2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为: .
(1)如图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:

| 化学键 | F-D | F-F | B-B | F-B | C═D | D═D |
| 键能/kJ?mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为
③已知加热下可发生如下转化:F(s)+D2(g)
| ||
根据上表数据计算F单质晶体发生上述反应的反应热△H为:
考点:位置结构性质的相互关系应用
专题:
分析:“A、E分别都能与D按原子个数1:1或2:1形成化合物”,则D为O元素,结合“A、B、C、D、E、F核电荷数依次增大”可知A为H元素,E为Na元素.又“B、C分别能与O按原子个数1:1或1:2形成化合物”,推知B为C元素,C为N元素.“B与F同主族”,则F为Si元素,
(1)虚线表示表示氢键,E与D按原子个数比1﹕1形成的化合物为Na2O2;
(2)①a.SiC为原子晶体,b.CO2为分子晶体,c.晶体硅为原子晶体.熔点:原子晶体>分子晶体;同为原子晶体时,键能越大,熔点越高;
②F为Si元素,硅单质晶体中一个Si原子与其紧邻的4个Si原子形成的空间四面体构型;
③1molSi晶体中含有2molSi-Si键,与氧气反应的化学方程式为Si+O2
SiO2,反应热等于反应物的总键能减生成物的总键能,据此计算.
(1)虚线表示表示氢键,E与D按原子个数比1﹕1形成的化合物为Na2O2;
(2)①a.SiC为原子晶体,b.CO2为分子晶体,c.晶体硅为原子晶体.熔点:原子晶体>分子晶体;同为原子晶体时,键能越大,熔点越高;
②F为Si元素,硅单质晶体中一个Si原子与其紧邻的4个Si原子形成的空间四面体构型;
③1molSi晶体中含有2molSi-Si键,与氧气反应的化学方程式为Si+O2
| ||
解答:
解:“A、E分别都能与D按原子个数1:1或2:1形成化合物”,则D为O元素,结合“A、B、C、D、E、F核电荷数依次增大”可知A为H元素,E为Na元素.又“B、C分别能与D按原子个数1:1或1:2形成化合物”,推知B为C元素,C为N元素.“B与F同主族”,则F为Si元素,
(1)其中的虚线表示表示氢键,E与D按原子个数比1﹕1形成的化合物为Na2O2,电子式为 ,故答案为:氢键;
,故答案为:氢键; ;
;
(2)①a.SiC为原子晶体,b.CO2为分子晶体,c.晶体硅为原子晶体.熔点:原子晶体>分子晶体;同为原子晶体时,键能越大,熔点越高.所以熔点由高到低的顺序为a>c>b,故答案为:a>c>b;
②F为Si元素,硅单质晶体中一个Si原子与其紧邻的4个Si原子形成的空间四面体构型,故答案为:正四面体;
③1molSi晶体中含有2molSi-Si键,与氧气反应的化学方程式为Si+O2
SiO2,反应热等于反应物的总键能减生成物的总键能,生成1molSiO2含有4mol Si-O键,则△H=2×176kJ/mol+497.3kJ/mol-4×460kJ/mol=-990.7kJ/mol,故答案为:-990.7 kJ/mol.
(1)其中的虚线表示表示氢键,E与D按原子个数比1﹕1形成的化合物为Na2O2,电子式为
 ,故答案为:氢键;
,故答案为:氢键; ;
;(2)①a.SiC为原子晶体,b.CO2为分子晶体,c.晶体硅为原子晶体.熔点:原子晶体>分子晶体;同为原子晶体时,键能越大,熔点越高.所以熔点由高到低的顺序为a>c>b,故答案为:a>c>b;
②F为Si元素,硅单质晶体中一个Si原子与其紧邻的4个Si原子形成的空间四面体构型,故答案为:正四面体;
③1molSi晶体中含有2molSi-Si键,与氧气反应的化学方程式为Si+O2
| ||
点评:本题综合考查元素位置、结构与性质的关系,综合考查学生的分析能力、推断能力和综合运用化学知识的能力,难度较大,注意把握热化学方程式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用水稀释0.1mol/L醋酸时,溶液中随着水量的增加而减小的是( )
A、
| ||
B、
| ||
C、
| ||
| D、c(OH-) |
在某温度下,可逆反应mA+nB?pC+qD平衡常数为K,下列说法正确的是( )
| A、K越大,达到平衡时,反应进行的程度越大 |
| B、K越小,达到平衡时,反应物的转化率越大 |
| C、K随反应物浓度的改变而改变 |
| D、K随着温度的升高而增大 |
下面不是化学方法处理污水的是( )
| A、过滤法 | B、混凝法 |
| C、中和法 | D、沉淀法 |
下列说法不正确的是( )
| A、氨气易液化,液氨气化时吸热,因此液氨常用作制冷剂 |
| B、氮的固定是指将游离态的氮转变为氮的化合物 |
| C、漂白粉和漂粉精的有效成分都是Ca(CIO)2 |
| D、SO2和CO2都是造成酸雨的主要气体 |
下列说法中不正确的是( )
| A、蓄电池在放电过程中,负极质量增加,正极质量也增加 |
| B、电解法是最强有力的氧化还原手段,可以将极难还原的活泼金属从它们的化合物中还原出来 |
| C、钢铁发生吸氧腐蚀时,负极反应式为:Fe-3e-═Fe3+ |
| D、电解精炼铜时,用纯铜板作阴极,粗作阳极,用硫酸铜溶液作电解液铜板 |
下列混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是( )
| A、甲烷、乙烯 |
| B、丙醛、丙醇 |
| C、甲醛、甲酸甲酯 |
| D、苯、甲苯 |
 向平底烧瓶中放入氢氧化钡固体[Ba(OH)2?8H2O]和氯化铵固体,塞紧瓶塞.在瓶底和木板间滴少量水,如图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板上因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味.这是自发地发生了反应:Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l).下列结论正确的是( )
向平底烧瓶中放入氢氧化钡固体[Ba(OH)2?8H2O]和氯化铵固体,塞紧瓶塞.在瓶底和木板间滴少量水,如图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板上因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味.这是自发地发生了反应:Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l).下列结论正确的是( )| A、该反应是一个熵减的反应 |
| B、该反应△H>0,△H-T△S<0 |
| C、吸热反应在常温下一定不能进行 |
| D、能自发进行的反应一定能迅速发生反应 |