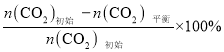题目内容
【题目】下列叙述中正确的有
①![]() 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则
②处于最低能量状态原子叫基态原子,![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
③运用价层电子对互斥理论,![]() 离子的空间构型为三角锥型
离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3 中 N-Cl 键的键长比 CCl4 中 C-Cl 键的键长短
A.1 个B.2 个C.3 个D.4 个
【答案】B
【解析】
①洪特规则内容是电子在能量相同的轨道上排布时,总是尽可能分占不同的轨道且自旋方向相同,该轨道式违背了洪特规则,①说法正确;
②处于最低能量状态原子叫基态原子,排布式为1s22s22px1和1s22s22py1电子能量相同,1s22s22px1→1s22s22py1过程中没有能量释放,②说法错误;
③CO32-的中心原子为C原子,价层电子对个数为=![]() =3, C原子sp2杂化,轨道构型为平面三角形,成键原子有三个,分子空间构型为平面三角形,③说法错误;,
=3, C原子sp2杂化,轨道构型为平面三角形,成键原子有三个,分子空间构型为平面三角形,③说法错误;,
④具有相同核外电子排布的粒子如O2-、Mg2+核外都有10个电子,其电子层结构相同,前者具有还原性,后者具有氧化性,化学性质不同,④说法错误;
⑤N原子的半径小于C原子的半径,所以NCl3 中 N-Cl 键的键长比 CCl4 中 C-Cl 键的键长短,⑤说法正确;
答案选B。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(用元素符号或化学式回答下列问题)
(1)在这些元素中,化学性质最不活泼的是_______,其原子结构示意图是_________。
(2)用电子式表示元素④与⑦组成的化合物的形成过程:________,该化合物属于_______(填“共价”或“离子”)化合物。
(3)常温下呈液态的非金属单质是_______。
(4)表中能形成两性氢氧化物的元素是_________,该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式是___________。
(5)①、⑥、⑦三种元素的最高价氧化物对应的水化物中,按酸性增强的顺序排列为_________。