题目内容
【题目】A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子的2p能级有3个电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(1)写出基态E+的价电子排布式:_________。基态A原子的第一电离能比B的大,其原因是__________。
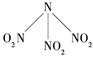
(2)A5+由美国空军研究实验室推进科学与先进概念部Karl .O. Christed 于1999年成功合成,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A5+的结构式为________。
(3)B3分子的空间构型为______,其中B原子的杂化类型是______,与B3分子互为等电子体的微粒有_________(写一种离子)。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的___________。 写出该配合物中配离子的结构简式__________。
(5)由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XYn,它们有很强的储氢能力,其中铜钙合金的晶体的部分结构如图所示。
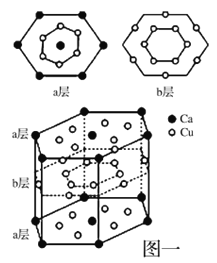
己知镧镍合金(LaNin)晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶体空隙,体积不变),则LaNin中n=___ (填数值);氢在合金中的密度为_______g/L。
【答案】 3d10 N原子价电子排布式为2S22P3,O原子为2s22p4,N的2p轨道达半满,更为稳定  v形 SP2 NO2- 降低[Cu(NH3)4]SO4·H2O的溶解度
v形 SP2 NO2- 降低[Cu(NH3)4]SO4·H2O的溶解度  n=5 密度是250g/L
n=5 密度是250g/L
【解析】B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素;
(1)Cu的核电荷数为29,基态Cu原子的电子排布式是1s22s22p63s23p63d104s1,则价电子排布式为3d104s1。基态N原子的核外电子排布为1s22s22p3,p轨道为半充满结构,较稳定,故其第I电离能比O的大;
(2). N5+共有24个价电子,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则N5+的结构式为
(3)O3中O原子的杂化类型是SP2,所以空间构型为v形,与O3分子互为等电子体的微粒有应具有3个原子和18个价电子,符合条件且为离子的可以是 NO2-。
(4)向CuSO4的水溶液中逐滴加入氨水,离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2H2O,至过量,观察到溶液由天蓝色最终变为深蓝色,生成[Cu(NH3)4]2+,反应的离子方程式为:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;
①该蓝色晶体的化学式为[Cu(NH3)4]SO4·H2O,加入乙醇的目的是向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:Cu(NH3)4SO4H2O,则加入乙醇的作用是降低了[Cu(NH3)4]SO4H2O的溶解度;
②[Cu(NH3)4]2+的结构式为![]() ;
;
(5)铜、钙合金中,N(Cu)=12![]() +6
+6![]() +6=15。N(Ca)=12×
+6=15。N(Ca)=12×![]() +2×
+2×![]() =3,
=3, ![]() =
=![]() =
=![]() ,所以n=5;因为合金的化学式为LaNinH4.5而一个晶胞中实际拥有三个La原子、5个Ni原子,所以实际含有氢原子4.5×3=13.5。ρ·9.0×10-23cm3·NA=M,其中氢在合金中的密度为
,所以n=5;因为合金的化学式为LaNinH4.5而一个晶胞中实际拥有三个La原子、5个Ni原子,所以实际含有氢原子4.5×3=13.5。ρ·9.0×10-23cm3·NA=M,其中氢在合金中的密度为![]() 0.25 g·cm-3=250g/L。
0.25 g·cm-3=250g/L。

【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模型 示意图 |
|
|
|
|
备注 | — | 易溶于CS2 | — | 熔点1 873 K |
A. HCN的结构式为H—C≡N,分子中含有2个σ键和2个π键
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键